
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Комплексонометрическое титрование смеси металлов
Селективное определение металлов в смесях возможно только при достаточном различии в величинах условных констант устойчивости их комплексонатов.
При комплексонометрическом титровании смеси двух металлов M’ и M” с погрешностью определения 0,1% необходимо, чтобы при оттитровывании M’ на 99,9% степень оттитровывания M’не превышала 0,1%. Тогда в этот момент титрования из выражения для условных констант устойчивости (2.3) получим:
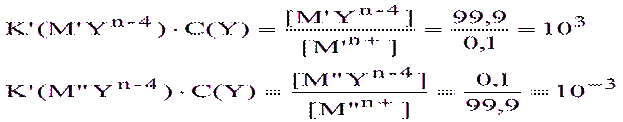
Отсюда следует, что для селективного определения металлов величина отношения K’(M’Yn-4)/K’(M”Yn-4) должна быть равна или больше 106. Если задаться меньшей точностью, например погрешностью 1%, то это отношение уменьшится до 104. При наличии дополнительного комплексообразования следует исходить из условных констант K”(MYn-4) (2.5).
Кривая комплексонометрического титрования смеси двух металлов в условиях селективного определения характеризуется двумя скачками при объемах титранта, соответствующих последовательному оттитровыванию ионов металлов; при этом первым титруется металл, образующий более прочный комплексонат.
Величина условной константы устойчивости комплексоната металла зависит от среды, в которой проводится определение, то есть от величины рН и дополнительного комплексообразования. Изменяя рН раствора или вводя маскирующий лиганд для связывания мешающего иона, можно достигнуть требуемого соотношения условных констант устойчивости и провести селективное определение металлов в смеси.
Например, анализ раствора, содержащего смесь ионов Pb2+ и Bi3+ проводят следующим образом. При рН=2 с индикатором пирокатехиновым фиолетовым оттитровывают раствором ЭДТА висмут, так как значение K’(BiY-) = 3·1014 больше 108 и определение возможно. Ион свинца при этом не мешает поскольку в этих условиях K’(PbY2-) = 4·104. Для его определения в анализируемый раствор добавляют ацетат натрия до рН=5 (образуется ацетатная буферная смесь) и дотитровывают Pb2+ комплексоном (K’(PbY2-) = 3,5·1011) с тем же индикатором.
Таким же способом можно раститровать ионы Fe3+ и Са2+ в их смеси, определив сначала в кислой среде железо, а затем при рН=9 кальций. Анализ водного раствора, содержащего ионы кальция и магния, приведен в разделе II данных методических указаний (работа 7).
Селективность определений может достигаться не только изменением кислотности среды, но и введением в анализируемый раствор дополнительного лиганда, образующего с ионами металлов комплексные соединения различной устойчивости. Например, комплексонаты кадмия и цинка при рН=9 характеризуются одинаковым значением условной константы устойчивости, что делает раздельное определение этих металлов в смеси при данных условиях невозможным. Однако, введение в анализируемый раствор иодидных ионов позволяет провести селективное комплексонометрическое титрование Cd2+ и Zn2+, так как кадмий образует более устойчивый иодидный комплекс, чем цинк, благодаря чему отношение условных констант устойчивостиK”(ZnY2-)/K”(CdY2-) становится больше 105.
Дополнительный лиганд может полностью связывать (маскировать) ионы некоторых металлов в прочные комплексы, что позволяет комплексонометрически титровать в их присутствии ионы других металлов. Например, добавление в анализируемый раствор цианидных ионов позволяет определять Са2+ в присутствии ионов кобальта, никеля, железа, ртути, цинка и других d-элементов, а с помощью тиомочевины устраняют мешающее действие ионов меди при определении железа.
7. Способы комплексонометрического титрования
Известны следующие четыре способа проведения комплексонометрического титрования – прямое титрование, обратное титрование (по остатку), титрование по способу вытеснения (замещения), косвенное титрование.
Прямое титрование – наиболее распространенный прием, когда к анализируемому раствору, содержащему ион определяемого металла, прибавляют рабочий раствор комплексона (титрант) до тех пор, пока не будет дотигнута точка эквивалентности, которую устанавливают с помощью индикатора. Прямое титрование удобно применять если есть возможность подобрать соответствующий индикатор и взаимодействие иона металла с комплексоном протекает достаточно быстро.
По результатам титрования рассчитывают содержание определяемого элемента. Расчеты в комплексонометрии можно проводить по закону эквивалентов, как это делается в других методах титрования. При этом следует учитывать, что при взаимодействии иона металла в любой степени окисления с комплексоном (ЭДТА) выделяется два иона водорода:
Mn++ H2Y2- «MYn-4+ 2H+
Поэтому факторы эквивалентности ЭДТА и иона металла, независимо от его заряда, всегда равны ½. Уравнение материального баланса в этом случае в соответствии с законом эквивалентов выглядит следующим образом:
n(1/2Mn+) = n(1/2H2Y2-) (7.1)
Поскольку по уравнению реакции на 1 моль металла всегда приходится 1 моль комплексона, то расчеты можно производить также исходя из равенства числа моль или миллимоль, учитывая при необходимости стехиометрические коэффициенты.
Пример 6. Какую навеску металлического цинка следует растворить в серной кислоте при определении точной концентрации 0,010 М раствора трилона Б с помощью макробюретки объёмом 25 мл: а) методом отдельных навесок; б) методом аликвотных частей (пипетирования), используя для этого мерную колбу и пипетку номинальным объёмом 100 и 10 мл соответственно? Рассчитать относительную погрешность взвешивания навески цинка на аналитических весах в обоих случаях.
Решение.
Zn2++ H2Y2- «ZnY2-+ 2H+
Для расчета используем объём раствора комплексона равный 80% от объёма бюретки V(H2Y2-) = 0,8·25 = 20 мл.
а) метод отдельных навесок:

тогда m(Zn) = 0,010·20·65,37·10-3= 0,013 г и 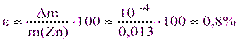
б) метод аликвотных частей:
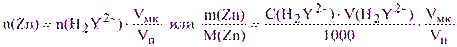
тогда m(Zn) = 0,010·20·65,37·10-3·10 = 0,13 г и 
Пример 7. Рассчитать массовую долю (%) сульфата железа(III) в образце, если после растворения его навески массой 0,2862 г в кислой среде на титрование израсходовали 22,38 мл 0,05 М (К = 1,018) раствора трилона Б.
Решение.
Fe3++ H2Y2- «FeY-+ 2H+
В одной молекуле Fe2(SO4)3 содержится два атома железа, тогда:
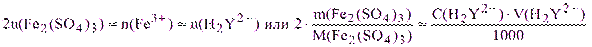
m(Fe2(SO4)3) = 0,05·1,018·22,38·399,88·10-3/2 = 0,2278 г
w(Fe2(SO4)3) = 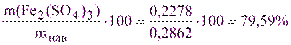
Задачу можно решить и по закону эквивалентов, тогда: n(1/4Fe2(SO)4) = n(1/2H2Y2-).
Обратное титрование (по остатку) – менее удобно, чем прямое, однако к нему приходится прибегать, когда для прямого титрования нельзя подобрать соответствующий индикатор, или когда катионы металла очень медленно взаимодействуют с титрантом, или когда при благоприятных значениях рН определяемый ион металла осаждается в виде гидроксидов. Во всех этих случаях к титруемому раствору прибавляют точно известный избыток комплексона, раствор выдерживают некоторое время для завершения реакции или ускоряют процесс нагреванием. Затем избыток комплексона титруют рабочим раствором соли другого металла (M’), для которого реакция с комплексоном соответствует всем требованиям, предъявляемым к реакциям комплексонометрического титрования. При обратном титровании комплексонат определяемого металла на определение точки эквивалентности практически не влияет, так как он образуется медленно и также медленно разрушается.
При обратном титровании уравнение материального баланса имеет вид:
n(H2Y2-) = n(Mn+) + n(M’n+)
или через эквиваленты:
n(1/2H2Y2-) = n(1/2Mn+) + n(1/2M’n+)
Пример 8. Рассчитать массу алюминия в анализируемом растворе, если к этому раствору при рН=5 добавили 20,00 мл 0,04520 М раствора трилона Б, затем после окончания реакции добавили аммиак до рН=9 (образовалась аммонийная буферная смесь) и остаток комплексона, не вступивший в реакцию с алюминием, оттитровали с металлохромным индикатором эриохромом черным Т, затратив 6,050 мл 0,05000 М раствора сульфата цинка.
Решение.
Al3++ H2Y2-изб «AlY-+ 2H++ (H2Y2-ост)
H2Y2-ост + Zn2+ «ZnY2-+ 2H+
Составляем уравнение материального баланса n(H2Y2-) = n(Al) + n(ZnSO4), тогда:
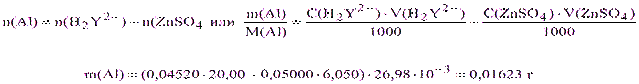
Титрование по способу вытеснения (замещения) – применяют в тех же случаях, что и обратное титрование. При вытеснительном (заместительном) титровании к анализируемому раствору, содержащему ион определяемого металла, прибавляют избыток комплексоната другого металла, условная константа устойчивости которого в данной среде меньше таковой для определяемого металла. Обычно применяют комплексонат магния, константа устойчивости которого lgK(MgY2-) = 8,7 (табл.1) значительно меньше, чем для большинства металлов. При этом протекает реакция замещения, после чего вытесненные ионы магния титруют при рН=9 раствором ЭДТА с металлохромным индикатором эриохромом черным Т:
Mn++ MgY2- «MYn-4+ Mg2+
Mg2++ H2Y2- «MgY2-+ 2H+
Чем больше разница в константах устойчивости MYn-4 и MgY2-, тем полнее идет реакция замещения. Если вытеснение магния происходит медленно, необходимо анализируемый раствор выдержать некоторое время до окончания реакции или ускорить её нагреванием.
Таким способом нельзя определить ионы бария, так как K(BaY2-) < K(MgY2-) (табл.1). Однако, если к раствору, содержащему ионы бария, добавить достаточное количество аммиака и комплексонат цинка, то произойдет реакция:
Ba2++ ZnY2-+ 4NH3 «BaY2-+ [Zn(NH3)4]2+
После чего аммиакат цинка при рН=9 титруют комплексоном в присутствии металлохромного индикатора эриохрома черного Т. Такое течение реакции замещения становится возможным, так как в данных условиях K’(BaY2-) > K”(ZnY2-).
Уравнение материального баланса, связывающее количество определяемого вещества и титранта, в заместительном титровании аналогично прямому титрованию.
Пример 9. Навеску кристаллогидрата Al(NO3)3· x H2O массой 1,7030 г растворили в мерной колбе объёмом 200,0 мл и к аликвоте полученного раствора 20,00 мл прибавили избыток комплексоната Na2MgY. На титрование выделившихся ионов магния израсходовали 17,45 мл 0,02507 М раствора трилона Б. Рассчитать массовую долю (%) Al(NO3)3 в исходном препарате.
Решение.
Al3++ MgY2- «AlY-+ Mg2+
Mg2++ H2Y2- «MgY2-+ 2H+
Из уравнения материального баланса имеем:
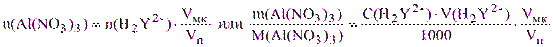
m(Al(NO3)3) = 0,02507·17,45·213,0·10-3·10 = 0,9318 г
w(Al(NO3)3) = 
Косвенное титрование – применяется для определения ионов, не взаимодействующих с комплексоном непосредственно, например, катионов щелочных металлов и некоторых анионов, образующих малорастворимые соединения.
Таким образом определяют ионы натрия, осаждая их в виде натрийцинкуранилацетата – NaZn(UO2)3(CH3COO)9, который затем растворяют в кислоте и комплексонометрически определяют образовавшиеся ионы цинка. При этом n(Na+) = n(Zn2+) = n(H2Y2-).
Аналогично определяют и анионы. Например, фосфатный ион можно осадить в виде MgNH4PO4, а затем растворить его в кислоте и после ионообменного отделения фосфата определить магний с помощью трилона Б. При этом n(PO43--) = n(H2Y2-).
Косвенное определение можно проводить и обратным титрованием. Например, при определении сульфатов к анализируемому раствору прибавляют точно известный избыток нитрата свинца и остаток последнего определяют комплексонометрически. Уравнение материального баланса при этом следующее: n(SO42-) = n(Pb2+) – n(H2Y2-).
Пример 10. Какая масса натрия содержалась в анализируемом растворе, если после осаждения его в виде натрийцинкуранилацетата полученный осадок отделили, растворили и на титрование образовавшихся ионов цинка затратили 20,85 мл 0,01 М (K = 0,9194) раствора трилона Б?
Решение.
Na++ Zn2++ 3UO22++ 9CH3COO- «NaZn(UO2)3(CH3COO)9¯
NaZn(UO2)3(CH3COO)9+ 9H+ «Na++ Zn2++ 3UO22++ 9CH3COOH
Zn2++ H2Y2- «ZnY2-+ 2H+
Уравнение материального баланса имеет вид:

откуда m(Na) = 0,01·0,9194·20,85·22,99·10-3 = 0,4407 г
II. ЛАБОРАТОРНЫЕ РАБОТЫ
Работа 1. Определение точной концентрации рабочего раствора трилона Б.
Сущность работы: Определение основано на взаимодействии раствора трилона Б со стандартным раствором сульфата цинка в присутствии аммонийной буферной смеси (рН ~ 9) по уравнению реакции:
Zn2+ + H2Y2- «ZnY2- + 2H+
Для определения конечной точки титрования применяется металлохромный индикатор эриохром черный Т.
Посуда и реактивы:
- конические колбы для титрования на 100 мл – 2 шт.;
- макробюретка на 25 мл – 1 шт.;
- аммонийная буферная смесь (рН ~ 9);
- сухая индикаторная смесь (тщательно растертые в ступке 0,5 г эриохрома черного Т и 50 г хлорида натрия);
- раствор сульфата цинка с точно известной концентрацией.
Выполнение работы:
Для работы следует получить в лаборантской водный раствор трилона Б с приближенной молярной концентрацией эквивалента 0,01-0,02 моль/л.
В конические колбы для титрования с помощью бюретки отбирают различные объемы (17-22 мл) стандартного раствора сульфата цинка. Затем аккуратно по каплям прибавляют 2 М раствор аммиака до появления белого осадка (гидроксид цинка) и его последующего растворения. К полученному раствору добавляют 10 мл аммонийной буферной смеси и сухую индикаторную смесь (на кончике шпателя) до получения фиолетовой окраски - очень интенсивная окраска не рекомендуется, так как при этом затрудняется наблюдение перехода окраски в конечной точке титрования. Далее титруют раствором трилона Б до перехода окраски в синюю (без примеси фиолетового), при этом последние капли титранта следует добавлять медленно, хорошо перемешивая раствор. Для облегчения определения конечной точки титрования можно приготовить раствор-свидетель, добавив к 50 мл дистиллированной воды 10 мл аммонийной буферной смеси, индикаторную смесь и немного раствора трилона Б до синей окраски. По показаниям бюретки определяют объём раствора трилона Б, пошедший на титрование, и полученные результаты заносят в таблицу:
| № пробы | V(ZnSO4), мл | V(H2Y2-), мл | 
| Dx = | xi –  | |
| 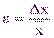 ·100, % ·100, %
|
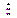
| |||||
 = =
|
По результатам 3-4 титрований (относительная погрешность не более 0,3%) рассчитывают молярную концентрацию эквивалента раствора трилона Б и его титр по кальцию. 

Работа 2. Определение содержания кальция в водном растворе.
Сущность работы: Определение основано на взаимодействии ионов кальция, находящихся в анализируемом растворе, с трилоном Б в присутствии аммонийной буферной смеси (рН ~ 9) по уравнению реакции:
Са2+ + H2Y2- «СаY2- + 2H+
Так как комплексонат кальция относительно малоустойчив (lgK = 10,7, табл.1), создание щелочной среды при анализе необходимо для сдвига реакции взаимодействия вправо. Для определения конечной точки титрования применяется металлохромный индикатор эриохром черный Т.
Посуда и реактивы:
- конические колбы для титрования на 100 мл – 2 шт.;
- макробюретка на 25 мл – 1 шт.;
- мерная колба объёмом 100 мл – 1 шт.;
- пипетка объёмом 10 мл – 1 шт.;
- аммонийная буферная смесь (рН ~ 9);
- сухая индикаторная смесь (тщательно растертые в ступке 0,5 г эриохрома черного Т и 50 г хлорида натрия);
- раствор трилона Б с точно известной концентрацией.
Выполнение работы:
Полученный в лаборантской в мерной колбе на 100 мл анализируемый раствор, содержащий ионы кальция, доводят до метки дистиллированной водой и тщательно перемешивают. Затем с помощью пипетки на 10 мл в конические колбы для титрования отбирают аликвотные пробы, составляющие 1/10 часть анализируемого раствора, добавляют 10 мл аммонийной буферной смеси, сухую индикаторную смесь (на кончике шпателя) до фиолетовой окраски и титруют раствором трилона Б до перехода окраски в синюю (без примеси фиолетового). По показаниям бюретки определяют объём раствора трилона Б, пошедший на титрование, и полученные результаты заносят в таблицу:
| № пробы | Vi(H2Y2-), мл | DV = |Vi - 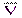 |,
мл |,
мл
| 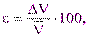 % %
|
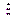
| |||
 = =
|
По результатам 3-4 титрований (относительная погрешность не более 0,3%) рассчитывают массу кальция в анализируемом растворе:



или:
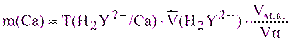


Работа 3. Определение содержания меди в водном растворе.
Сущность работы: Определение основано на взаимодействии ионов меди, находящихся в анализируемом растворе, с трилоном Б в присутствии ацетатной буферной смеси (рН ~ 4) по уравнению реакции:
Сu2+ + H2Y2- «СuY2- + 2H+
Титрование проводят в кислой среде, так как комплексонат меди обладает высокой устойчивостью (lgK = 18,8, табл,1) и при этом предотвращается образование малорастворимых основных солей и гидроксида меди. Для определения конечной точки титрования применяется металлохромный индикатор пиридилазонафтол (ПАН).
Посуда и реактивы:
- конические колбы для титрования на 100 мл – 2 шт.;
- макробюретка на 25 мл – 1 шт.;
- мерная колба объёмом 100 мл – 1 шт.;
- пипетка объёмом 10 мл – 1 шт.;
- ацетатная буферная смесь (рН ~ 4);
- 0,1% спиртовый раствор индикатора ПАН;
- раствор трилона Б с точно известной концентрацией.
Выполнение работы:
Полученный в лаборантской в мерной колбе на 100 мл анализируемый раствор, содержащий ионы меди, доводят до метки дистиллированной водой и тщательно перемешивают. Затем с помощью пипетки на 10 мл в конические колбы для титрования отбирают аликвотные пробы, составляющие 1/10 часть анализируемого раствора, добавляют 10 мл ацетатной буферной смеси, 4-5 капель раствора индикатора и титруют раствором трилона Б до перехода красно-фиолетовой окраски раствора в желтую. По показаниям бюретки определяют объём раствора трилона Б, пошедший на титрование. Оформление результатов анализа и расчет массы меди в анализируемом растворе проводят аналогично описанному в работе 2 при определении кальция.


Работа 4. Определение содержания кобальта в водном растворе.
Сущность работы: Определение основано на взаимодействии ионов кобальта, находящихся в анализируемом растворе, с трилоном Б в присутствии ацетатной буферной смеси (рН ~ 4) по уравнению реакции:
Со2+ + H2Y2- «СоY2- + 2H+
Титрование проводят в кислой среде, так как комплексонат кобальта обладает высокой устойчивостью (lgK = 16,3, табл,1) и при этом предотвращается образование малорастворимых основных солей и гидроксида кобальта. Для определения конечной точки титрования применяется металлохромный индикатор ксиленоловый оранжевый (КО).
Посуда и реактивы:
- конические колбы для титрования на 100 мл – 2 шт.;
- макробюретка на 25 мл – 1 шт.;
- мерная колба объёмом 100 мл – 1 шт.;
- пипетка объёмом 10 мл – 1 шт.;
- ацетатная буферная смесь (рН ~ 4);
- 0,1% спиртовый раствор индикатора КО;
- раствор трилона Б с точно известной концентрацией.
Выполнение работы:
Полученный в лаборантской в мерной колбе на 100 мл анализируемый раствор, содержащий ионы кобальта, доводят до метки дистиллированной водой и тщательно перемешивают. Затем с помощью пипетки на 10 мл в конические колбы для титрования отбирают аликвотные пробы, составляющие 1/10 часть анализируемого раствора, добавляют 10 мл ацетатной буферной смеси,3-4 капели раствора индикатора и титруют раствором трилона Б до перехода красной окраски раствора в желтую. По показаниям бюретки определяют объём раствора трилона Б, пошедший на титрование. Оформление результатов анализа и расчет массы кобальта в анализируемом растворе проводят аналогично описанному в работе 2 при определении кальция.
Работа 5. Определение содержания алюминия в водном растворе.
Сущность работы: Определение алюминия в растворе проводят методом обратного титрования (по остатку), так как взаимодействие ионов алюминия с трилоном Б протекает медленно. При этом в анализируемый раствор добавляют точно известное избыточное количество комплексона, остаток которого, не вступивший в реакцию с алюминием, оттитровывают стандартным раствором сульфата цинка. Взаимодействие протекает по уравнениям реакций:
Al3+ + H2Y2-изб «AlY- + 2H+(+ H2Y2-ост)
H2Y2-ост + Zn2+ «ZnY2-+ 2H+
Взаимодействие ионов алюминия с трилоном Б осуществляется в нейтральной среде, а титрование остатка комплексона сульфатом цинка в присутствии аммонийной буферной смеси (рН ~ 9) Для определения конечной точки титрования применяется металлохромный индикатор эриохром черный Т.
Посуда и реактивы:
- конические колбы для титрования на 100 мл – 2 шт.;
- макробюретка на 25 мл – 1 шт.;
- мерная колба объёмом 100 мл – 1 шт.;
- пипетка объёмом 10 мл – 1 шт.;
- пипетка объёмом 50 мл – 1 шт.;
- аммонийная буферная смесь (рН ~ 9);
- сухая индикаторная смесь (тщательно растертые в ступке 0,5 г эриохрома черного Т и 50 г хлорида натрия);
- раствор трилона Б с точно известной концентрацией;
- раствор сульфата цинка с точно известной концентрацией.
Выполнение работы:
Полученный в лаборантской в мерной колбе на 100 мл анализируемый раствор, содержащий ионы алюминия, доводят до метки дистиллированной водой и тщательно перемешивают. Затем с помощью пипетки на 10 мл в конические колбы для титрования отбирают аликвотные пробы, составляющие 1/10 часть анализируемого раствора, добавляют пипеткой 50 мл раствора трилона Б и выдерживают на водяной бане (60-700С) в течение 10-15 мин, что необходимо для полного протекания реакции. После охлаждения до комнатной температуры добавляют 5 мл аммонийной буферной смеси, сухую индикаторную смесь (на кончике шпателя) и оттитровывают избыток трилона Б раствором сульфата цинка до перехода окраски из синей в фиолетовую. По показаниям бюретки определяют объём раствора сульфата цинка, пошедший на титрование, и полученные результаты заносят в таблицу:
| № пробы | Vi(ZnSO4), мл | DV = |Vi – 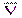 |,
мл |,
мл
| 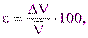 % %
|
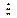
| |||
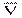 = =
|
По результатам 3-4 титрований (относительная погрешность не более 0,3%) рассчитывают массу алюминия в анализируемом растворе:
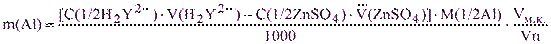


Работа 6. Определение общей жесткости воды.
Сущность работы: Общая жесткость воды обусловлена присутствием в ней солей кальция и магния и выражается суммарным числом миллимоль эквивалентов (ммоль-экв) ионов кальция и магния в 1 л воды. Определение основано на взаимодействии ионов кальция и магния, находящихся в анализируемом растворе, с трилоном Б в присутствии аммонийной буферной смеси (рН ~ 9) по уравнению реакции:
Са2+ + Mg2+ + 2H2Y2- «СаY2-+ MgY2- + 4H+
Для определения конечной точки титрования применяется металлохромный индикатор эриохром черный Т.
Посуда и реактивы:
- конические колбы для титрования на 250 мл – 2 шт.;
- макробюретка на 25 мл – 1 шт.;
- пипетка объёмом 50 мл – 1 шт.;
- аммонийная буферная смесь (рН ~ 9);
- сухая индикаторная смесь (тщательно растертые в ступке 0,5 г эриохрома черного Т и 50 г хлорида натрия);
- раствор трилона Б с точно известной концентрацией.
Выполнение работы:
Пипеткой на 50 мл отбирают пробы анализируемой воды в конические колбы для титрования, прибавляют 5 мл аммонийной буферной смеси, сухую индикаторную смесь (на кончике шпателя) до фиолетовой окраски, разбавляют дистиллированной водой до объёма 100 мл и титруют раствором трилона Б до перехода окраски в синюю (без примеси фиолетового). По показаниям бюретки определяют объём раствора трилона Б, пошедший на титрование, и полученные результаты заносят в таблицу:
| № пробы | Vi(H2Y2-), мл | DV = |Vi –  |,
мл |,
мл
| 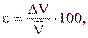 % %
|
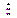
| |||
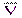 = =
|
По результатам 3-4 титрований (относительная погрешность не более 0,3%) рассчитывают общую жесткость (Ж, ммоль-экв/л) анализируемой воды:
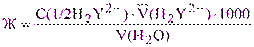


Для перевода полученной величины в градусы жесткости (Ж0) её следует умножить на коэффициент равный 2,8: Ж0 = 2,8·Ж.
Работа 7. Определение содержания кальция и магния в водном растворе при
совместном присутствии.
Сущность работы: В первой аликвоте титрованием трилоном Б в присутствии аммонийной буферной смеси (рН ~ 9) и металлохромного индикатора эриохрома черного Т определяют суммарное количество ионов кальция и магния (n1), находящихся в анализируемом растворе:
Са2+ + Mg2+ + 2H2Y2- «СаY2-+ MgY2- + 4H+
Затем, титруя вторую аликвоту в щелочном растворе (рН > 11) в присутствии металлохромного индикатора мурексида, определяют количество ионов кальция (n2):
Са2+ + H2Y2- «СаY2- + 2H+
Ионы магния при этом выпадают в осадок в виде гидроксида и не титруются; их количество находят по разности двух определений (n1 – n2).
Посуда и реактивы:
- конические колбы для титрования на 100 мл – 2 шт.;
- макробюретка на 25 мл – 1 шт.;
- мерная колба объёмом 100 мл – 1 шт.;
- пипетка объёмом 10 мл – 1 шт.;
- аммонийная буферная смесь (рН ~ 9);
- 6 М раствор гидроксида натрия;
- сухая индикаторная смесь (тщательно растертые в ступке 0,5 г эриохрома черного Т и 50 г хлорида натрия);
- сухая индикаторная смесь (тщательно растертые в ступке 0,5 г мурексида и 50 г хлорида натрия);
- раствор трилона Б с точно известной концентрацией.
Выполнение работы:
Полученный в лаборантской в мерной колбе на 100 мл анализируемый раствор, содержащий ионы кальция и магния, доводят до метки дистиллированной водой и тщательно перемешивают. Затем с помощью пипетки на 10 мл в конические колбы для титрования отбирают 3-4 аликвотные пробы, составляющие 1/10 часть анализируемого раствора, добавляют 10 мл дистиллированной воды, 10 мл аммонийной буферной смеси, сухую индикаторную смесь эриохрома черного Т (на кончике шпателя) до фиолетовой окраски и титруют раствором трилона Б до перехода окраски в синюю (без примеси фиолетового). По показаниям бюретки определяют объём раствора трилона Б (V1), пошедший на титрование суммарного количества кальция и магния, и полученные результаты заносят в таблицу:
| № пробы | V1i(H2Y2-), мл | DV = | V1i – 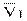 |,
мл |,
мл
|  % %
|
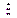
| |||
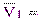
|
Далее с помощью пипетки на 10 мл в конические колбы для титрования отбирают 3-4 аликвотные пробы, составляющие 1/10 часть анализируемого раствора, добавляют 25 мл дистиллированной воды, 5 мл 6 М раствора гидроксида натрия, сухую индикаторную смесь мурексида (на кончике шпателя) до розовой окраски и титруют раствором трилона Б до перехода окраски в фиолетовую. По показаниям бюретки определяют объём раствора трилона Б (V2), пошедший на титрование кальция, и полученные результаты заносят в таблицу:
| № пробы | V2i(H2Y2-), мл | DV = | V2i – 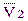 |,
мл |,
мл
| 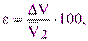 % %
|
| |||

|
По результатам 3-4 титрований (относительная погрешность не более 0,3%) рассчитывают массу кальция и магния в анализируемом растворе:
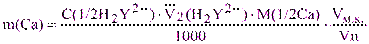


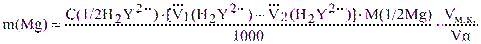


III. КОНТРОЛЬНЫЕ ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ СТУДЕНТОВ
1. Приведите структурные формулы комплексонов и комплексонатов металлов с ними. Каковы особенности протекания реакций комплексообразования при комплексонометрическом титровании?
2. Как готовят рабочий раствор трилона Б и определяют его точную концентрацию?
3. Истинная константа устойчивости и условие применимости реакции комплексообразования в комплексонометрии. Перечислите факторы влияющие на величину константы устойчивости.
4. Как рассчитать условную константу устойчивости комплексоната при заданном рН раствора? Как влияет кислотность среды на устойчивость комплексонатов?
5. Как влияет присутствие дополнительных лигандов на устойчивость комплексонатов? Какая константа учитывает это влияние?
6. В каких координатах производится построение кривых комплексонометрического титрования? Нарисуйте типичную кривую комплексонометрического титрования. Как влияет на величину скачка прочность образующегося комплексоната?
7. Вывести формулы для расчета кривой комплексонометрического титрования при заданном значении рН. Как влияет на величину скачка на кривой титрования кислотность среды?
8. Каковы особенности расчета кривой комплексонометрического титрования с учетом дополнительного комплексообразования? Как влияет концентрация дополнительного лиганда на величину скачка на кривой комплексонометрического титрования?
9. Как зависит величина скачка на кривой комплексонометрического титрования от концентрации реагирующих веществ? В каком случае при титровании 0,01 М раствора MgSO40,01 М или 0,1 М раствором ЭДТА величина скачка будет больше?
10. В каком случае величина скачка титрования будет наибольшей и в каком – наименьшей, если титруют 0,01 М раствором ЭДТА: а) 0,01 М растворы MgSО4, ZnSO4, CoSO4при рН=7; б) 0,01 М и 5·10-3 М растворы CaCl2 при рН=9; в) 0,01 М раствор NiSO4 при рН=9 в присутствии 0,1 М и 0,05 М аммонийной буферной смеси?
11. Почему комплексонометрическое определение ионов Сo2+, Zn2+, Ni2+, Cd2+ проводят в среде аммонийного буфера?
12. Почему определение катионов с зарядом 3+ и 4+ с помощью комплексонов проводят в кислой среде?
13. Как с помощью условных констант устойчивости определить оптимальные по рН условия комплексонометрического титрования, например, 0,01 М раствора CaCl2 0,01 М раствором трилона Б?
14. Как с помощью условных констант устойчивости определить оптимальные по концентрации аммиака условия комплексонометрического титрования при заданном рН, например, 0,02 М раствора ZnCl2 0,02 М раствором ЭДТА при рН=9?
15. Вычислить условные константы устойчивости комплексов с ЭДТА и оценить возможность раздельного титрования компонентов в смеси: а) Сu2+, Zn2+, Pb2+ при рН=9 и рCN=1; б) Ni2+и Ca2+ при рН=10 и рNH3=2.
16. Как провести последовательное комплексонометрическое определение компонентов смеси: а) Bi3+, Pb2+; б) Zn2+, Mg2+; в) Fe3+, Ca2+; г) Fe3+, Al3+, Mg2+?
17. В чем сущность раздельного комплексонометрического титрования компонентов смеси с использованием маскирующих реагентов: а) Cu2+ и Pb2+ в присутствии KCN; б) Ni2+ и Fe3+ в присутствии KF; в) Hg2+ и Zn2+ в присутствии KJ?
18. Каков механизм действия металлохромных индикаторов в комплексонометрии? Приведите структурную формулу эриохрома черного Т и охарактеризуйте его свойства. Почему этот индикатор применяют в нейтральной и слабощелочной средах?
19. Охарактеризуйте свойства металлохромных индикаторов ПАР и ПАН и укажите область их применения при комплексонометрическом титровании.
20. Металлохромные индикаторы на основе трифенилметановых красителей, их свойства и область применения.
21. Как осуществляется рациональный выбор металлохромного индикатора при комплексонометрическом титровании? Что такое показатель металлохромного индикатора рТМ?
22. В чем заключается сущность прямого комплексонометрического титрования? Как выглядит уравнение материального баланса в этом случае?
23. В каких условиях (рН, температура, среда) следует проводить прямое титрование раствором трилона Б при определении: а) кальция с мурексидом; б) висмута с пирокатехиновым фиолетовым; в) меди с ПАН; г) цинка с эриохромом черным Т?
24. В чем заключается сущность обратного комплексонометрического титрования (титрование по остатку) и в каких случаях его применяют на практике? Как выглядит уравнение материального баланса в этом случае?
25. В каких условиях (рН, температура, среда, индикатор) следует проводить комплексонометрическое определение алюминия способом обратного титрования?
26. В чем заключается сущность вытеснительного комплексонометрического титрования (титрование по замещению) и в каких случаях его применяют на практике? Как выглядит уравнение материального баланса в этом случае?
27. В каких условиях (рН, температура, среда, индикатор) следует проводить комплексонометрическое определение способом вытеснительного титрования: а) Al3+ в присутствии комплексоната магния; б) Ва2+ в присутствии комплексоната цинка?
28. Каковы особенности косвенного комплексонометрического определения сульфатов?
29. Как определяют жесткость воды с помощью комплексонометрического титрования?
30. В чем сущность комплексонометрического определения кальция и магния в водном растворе при совместном присутствии? Расчетные формулы.
ЛИТЕРАТУРА
1. Харитонов Ю.Я. Аналитическая химия. Аналитика. В 2-х кн.- М.:Высш.шк., 2001. Кн.1. - 615 с.
2. Золотов Ю.А. Основы аналитической химии. В 2-х т. – М.:Высш.шк.,1999. Т.2. – 493 с.
3. Васильев В.П. Аналитическая химия. В 2-х ч. – М.:Высш.шк., 1989. Ч.1. – 320 с.
4. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В 2-х кн. – М.:Химия, 1990. Кн.1. – 480 с.
5. Пономарев В.Д. Аналитическая химия. В 2-х ч.– М.:Высш.шк.,1982. Ч.2. – 288 с.
6. Алексеев В.Н. Количественный анализ. – М.:Химия, 1972. – 504 с.
7. Крешков А.П. Основы аналитической химии. В 3-х т. – М.:Химия, 1976. Т.2. – 376 с.
8. Фритц Дж., Шенк Г. Количественный анализ. – М.:Мир, 1978. – 577 с.
9. Умланд Ф., Янсен А., Тириг Д., Вюнш Г. Комплексные соединения в аналитической химии. – М.:Мир, 1975. – 531 с.
10. Лурье Ю.Ю. Справочник по аналитической химии. – М.:Химия, 1989. – 448 с.
11. Государственная фармакопея СССР. XI. – М.:Медицина, 1987. Вып.1. – 336 с.
Date: 2015-09-24; view: 12422; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |