
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

I. Теоретические основы комплексонометрического
ТИТРОВАНИЯ
1. Комплексоны и их свойства
Комплексоны – это специальные органические комплексообразующие реагенты класса аминополикарбоновых кислот, которые являются полидентатными лигандами, связывающие ионы металлов по типу внутрикомплексных солей и широко применяемые в качестве титрантов при количественном определении металлов. Впервые использовать комплексоны в аналитической химии предложил в 1949 г. швейцарский ученый Г.Шварценбах.
Простейшим комплексоном является нитрилотриуксусная кислота (комплексон I, H3Y):
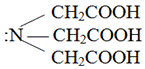
Комплексон I взаимодействует с ионами металлов в молярном соотношении 1:1 и способен образовывать с металлом четыре связи, одна из которых носит донорно-акцепторный характер за счет неподеленной электронной пары атома азота, а три другие ионный – за счет замещения трех ионов водорода карбоксильных групп на ион металла:
Mn++ H3Y «MYn-3+ 3H+
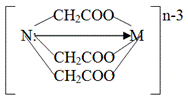
Анион нитрилотриуксусной кислоты при этом четырехдентатен, а комплекс его с металлом (комплексонат) имеет тетраэдрическое строение.
Наиболее распространенными комплексонами являются слабая четырехосновная этилендиаминтетрауксусная кислота (комплексон II, ЭДТУК, H4Y) и дигидрат её динатриевой соли (комплексон III, ЭДТА, Na2H2Y·2H2O, торговое название «Трилон Б»):
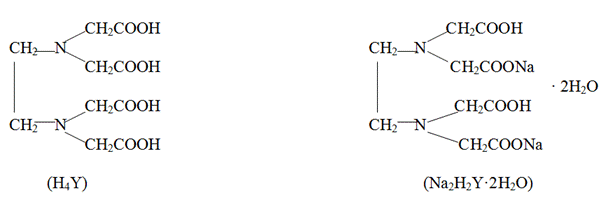
Четырехзарядный анион этилендиаминтетрауксусной кислоты (Y4-) способен образовывать с ионами металлов шесть связей (шестидентатный лиганд), две из которых за счет атомов азота и четыре – за счет ацетатных групп. С двух-, трех- и четырехзаряженными ионами металлов анион Y4- образует тетраэдрические (Ca2+, Mg2+, Ba2+) и октаэдрические комплексы (комплексонаты) состава MYn-4, где n – заряд иона металла.

Комплексонаты практически всех металлов бесцветны и хорошо растворимы в воде.
При комплексонометрическом титровании чаще применяют двунатриевую соль этилендиаминтетрауксусной кислоты (трилон Б), так как она значительно лучше растворима в воде, чем сама кислота. Эта соль образуется в реакции нейтрализации кислоты щелочью:
H4Y + 2NaOH ® Na2H2Y + 2H2O
Такое течение реакции обусловлено тем, что константы двух первых ступеней диссоциации этилендиаминтетрауксусной кислоты значительно превосходят последующие ступенчатые константы диссоциации: Ka1= 1·10-2(pKa1= 2,0), Ka2= 2,1·10-3(pKa2= 2,7), Ka3= 6,9·10-7(pKa3= 6,2), Ka4= 5,5·10-11(pKa4= 10,3). Близкие значения Ka1и Ka2 и их большое отличие от последующих констант диссоциации связано с бетаиновой структурой кислоты:
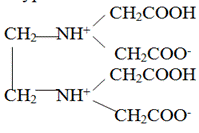
Из величин ступенчатых констант диссоциации следует, что этилендиаминтетрауксусная кислота (H4Y) в нейтральной среде существует преимущественно в виде анионов H2Y2-. По мере увеличения рН раствора образуются ионы HY3- и Y4-, причем последние преобладают в сильно щелочной среде при рН > 11.
В практике комплексонометрического титрования основным рабочим раствором является раствор дигидрата динатриевой соли этилендиаминтетрауксусной кислоты, которая выпускается промышленностью под торговым названием «трилон Б» со степенью очистки «ХЧ» (химически чистый) или «ЧДА» (чистый для анализа). Трилон Б хорошо растворим в воде и его растворы устойчивы при хранении. Рабочий раствор трилона Б можно готовить по точной навеске (с учетом влажности образца), однако обычно его точную концентрацию определяют по стандартному раствору сульфата цинка (см. разд.II, раб.1), который получают растворением точной навески металлического цинка в серной кислоте.
Исходя из всего выше сказанного, реакция между ионом металла и трилоном Б может быть записана в следующем виде:
Mn++ H2Y2- «MYn-4+ 2H+
При этом следует отметить ряд особенностей протекания реакции, благодаря которым комплексонометрия получила широкое применение в химическом анализе:
1. в результате реакции образуются комплексы только одного состава с соотношением металл:лиганд равным 1:1 (комплексонаты); при этом комплексонаты бесцветны, хорошо растворимы в воде и обладают высокой устойчивостью, так как центральный атом металла прочно связан полидентатным хелатным лигандом;
2. реакция является обратимым процессом и может быть сдвинута как в сторону образования, так и в сторону разрушения комплексоната, что легко достигается с помощью варьирования величины рН раствора – подкисление приводит к смещению равновесия влево к исходным реагентам, а подщелачивание способствует образованию комплексоната;
3. в результате реакции выделяются ионы водорода, поэтому её следует проводить в буферной среде, поддерживая оптимальное значение рН, определяемое константой устойчивости комплексоната.
2. Устойчивость комплексонатов металлов в водных растворах
При практическом применении комплексонометрического титрования важно знать насколько полно протекает реакция комплексообразования в тех или иных условиях, в первую в среде с определенным значением рН и в присутствии других лигандов, способных образовывать комплексы с определяемым металлом. Такую оценку осуществляют с помощью истинных и условных констант устойчивости (образования).
2.1. Истинная константа устойчивости комплексонатов
В реакции комплексообразования ионов металла с комплексоном участвует только полностью ионизированная форма Y4-:
Mn++ Y4- «MYn-4
Константа этого равновесия, выраженная через концентрации реагирующих и образующихся частиц, называется истинной концентрационной константой образования или устойчивости комплексоната K (или b):
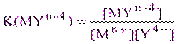 (2.1)
(2.1)
Концентрационная константа устойчивости комплексоната не зависит от концентрации участников реакции и величины рН раствора. Величина константы, а следовательно, устойчивость комплексоната, определяется природой иона металла, его зарядом, радиусом и электронным строением, ионной силой раствора, природой растворителя и температурой. Чем больше константа, тем более устойчив комплексонат. В табл.1 приведены численные значения логарифмов констант устойчивости комплексонатов некоторых металлов с ЭДТА в водном растворе при 200С и ионной силе 0,1.
Таблица 1
Логарифмы констант устойчивости комплексонатов с ЭДТА в водном растворе
при 200С и ионной силе 0,1.
| Ионы | lgK(MYn-4) | Ионы | lgK(MYn-4) |
| Ba2+ Mg2+ Ca2+ Fe2+ Al3+ Co2+ Ce3+ Cd2+ Zn2+ Pb2+ | 7,8 8,7 10,7 14,3 16,1 16,3 16,4 16,5 16,5 18,0 | Ni2+ Cu2+ Hg2+ Cr3+ Th4+ Ce4+ Fe3+ U4+ Bi3+ Zr4+ | 18,6 18,8 21,8 23,0 23,0 24,2 25,1 25,2 27,9 29,5 |
Наибольшими константами устойчивости характеризуются комплексонаты многозарядных, небольших по размеру ионов p- и d- элементов (Zr4+, Bi3+, Fe3+, Ce4+ и др.) (табл.1). Однако, силы взаимодействия между центральным атомом и анионом комплексона Y4- не являются чисто электростатическими, так как имеет место ковалентное донорно-акцепторное взаимодействие иона металла с неподеленной электронной парой атома азота, да и взаимодействие иона металла с карбоксилатной группой лиганда не носит чисто ионный характер, а сопровождается поляризационными эффектами. Увеличение устойчивости комплексонатов обусловлено и так называемым хелатным эффектом, связанным с образованием в комплексе прочных 5- и 6-членных циклов. Ценным свойством ЭДТА является способность образовывать достаточно прочные комплексы с ионами щелочноземельных металлов (s- элементы) – Ba2+, Mg2+, Ca2+, перевод которых в комплексные соединения другими реагентами практически невозможен.
Реакция комплексообразования может быть использована в количественном анализе необходимо, если она протекает с достаточной полнотой, то есть на 99,99%. При этом в точке эквивалентности остаточные концентрации [Mn+] и [Y4-] составляют 0,01% от исходной концентрации (или 1·10-4 от единицы). Тогда по уравнению (2.1) имеем:
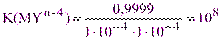
Это означает, что количественное комплексонометрическое определение металла возможно, если константа устойчивости комплексоната не менее 108. Однако, кислотность среды и дополнительные комплексообразователи сильно влияют на образование комплекса MYn-4, что учитывают с помощью условных констант устойчивости. Знание их величин дает возможность ответить на вопрос, возможно ли комплексонометрическое определение данного иона металла с требуемой точностью в данной конкретной среде.
2.2. Условная константа устойчивости комплексонатов при заданном рН
Влияние рН среды при комплексонометрическом титровании учитывают с помощью коэффициента конкурирующей реакции a(Y4-), отражающего протонирование лиганда Y4- и представляющего собой мольную долю ионов Y4- в общей концентрации несвязанного с металлом комплексона C(Y), находящегося в различных формах протонирования C(Y) = [H4Y] + [H3Y-] + [H2Y2-] + [HY3-] + [Y4-]:
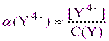 , откуда [Y4-] = C(Y)·a(Y4-) (2.2)
, откуда [Y4-] = C(Y)·a(Y4-) (2.2)
Значения a(Y4-) при различных значениях рН приведены в табл.2.
Таблица 2
Значения a(Y4-) для ЭДТА в водных растворах при различных рН
| РН | a(Y4-) | pH | a(Y4-) |
| 1,0 2,0 3,0 4,0 5,0 6,0 7,0 | 5,7·10-18 3,7·10-14 2,5·10-11 3,6·10-9 3,5·10-7 2,2·10-5 4,8·10-4 | 8,0 9,0 10,0 11,0 12,0 13,0 14,0 | 5,4·10-3 5,2·10-2 3,5·10-1 8,5·10-1 9,8·10-1 1,0 1,0 |
Как и следовало ожидать, величина a(Y4-), то есть мольная доля ионов Y4-, возрастает с увеличением рН раствора. Для промежуточных значений рН величина a(Y4-) может быть рассчитана по известной формуле:
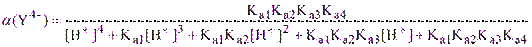 (2.2’)
(2.2’)
Преобразуем уравнение (2.1), подставив вместо [Y4-] её выражение из (2.2):
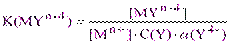 ,
,
откуда 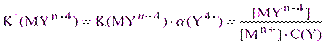 (2.3)
(2.3)
Величина K’ называется условной константой устойчивости и она, в отличие от истинной концентрационной константы, зависит от величины рН раствора.
Зная значения концентрационной константы устойчивости (табл.1) и коэффициента a(Y4-) при заданном рН (табл.2), можно рассчитать величину условной константы устойчивости комплексоната (2.3) и, сравнив её с 108, сделать заключение о возможности количественного комплексонометрического определения металла в данной среде.
Пример 1. Оценить, возможно ли количественно комплексонометрически оттитровать раствором трилона Б ионы никеля и кальция при: а) рН=5; б) рН=9.
Решение. Из табл.1 lgK(NiY2-) = 18,6, т.е. K(NiY2-) = 4·1018, а lgK(СаY2-) = 10,7, т.е. K(СаY2-) = 5·1010.
а) рН=5. Из табл.2 a(Y4-) = 3,5·10-7. Тогда по (2.3):
K’(NiY2-) = 4·1018·3,5·10-7= 1,4·1012> 108, количественное определение никеля возможно.
K’(СаY2-) = 5·1010·3,5·10-7= 1,75·104< 108, количественное определение кальция невозможно.
б) рН=9. Из табл.2 a(Y4-) = 5,2·10-2. Тогда по (2.3):
K’(NiY2-) = 4·1018·3,5·10-2= 1,4·1017> 108, количественное определение никеля возможно.
K’(СаY2-) = 5·1010·5,2·10-2= 2,6·109> 108, количественное определение кальция возможно.
Из приведенного примера видно, что ионы кальция можно определять только в щелочной среде, так как его малоустойчивый комплекс с ЭДТА разрушается уже в слабокислой среде. Более прочный комплексонат никеля устойчив и при рН = 5, однако, в более кислой среде (рН=2, K’ = 4·1018·3,7·10-14 = 1,5·105< 108) количественное определение никеля становится невозможным. При такой кислотности могут существовать только комплексонаты с большой константой устойчивости (lgK > 22). Таким образом, варьируя кислотность реакционной среды, можно осуществлять селективное определение металлов в смеси.
2.3. Условная константа устойчивости комплексонатов при дополнительном
комплексообразовании иона металла
Комплексонометрическое определение металлов осуществляется при постоянном значении рН раствора, поддерживаемое с помощъю буферных смесей, в состав которых входят частицы (L), например, молекулы аммиака, хлорид-, гидроксид-ионы и др., способные образовывать комплексные соединения с ионами металла, несвязанными с комплексоном. При этом образуется ряд дополнительных комплексов различного состава, влияние которых учитывают с помощью коэффициента конкурирующей реакции a(Mn+), представляющего собой мольную долю ионов Mn+в общей концентрации несвязанного с комплексоном иона металла с учетом дополнительного комплексообразования С(M) = [Mn+] + [MLn+] + [ML2n+] + · · · + [MLmn+]:
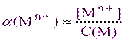 , откуда [Mn+] = C(M)·a(Mn+) (2.4)
, откуда [Mn+] = C(M)·a(Mn+) (2.4)
Преобразуем уравнение (2.1), подставив вместо [Mn+] и [Y4-] их выражения из (2.4) и (2.2):
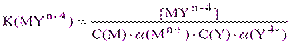 ,
,
откуда 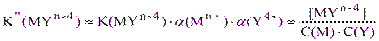 (2.5)
(2.5)
Величина K” называется условной константой устойчивости комплексоната в случае дополнительного комплексообразования иона металла и с учетом протонирования комплексона.
Значение a(Mn+) рассчитывают из величин общих (кумулятивных) констант устойчивости комплексов MLn+, ML2n+··· MLmn+(b1,b2··· bm), которые являются произведением соответствующих ступенчатых констант устойчивости (b1 = K1; b2= K1·K2 и т.д.), и равновесной концентрации лиганда L:
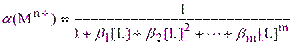 (2.6)
(2.6)
Пример 2. Рассчитать условную константу устойчивости комплексоната меди с ЭДТА в 0,01 М растворе аммиака при рН=9 и сделать заключение о возможности количественного определения меди в этих условиях.
Решение. Из табл.1 lgK(CuY2-) = 18,8, т.е. K(CuY2-) = 6·1018; из табл.2 при рН=9 a(Y4-) = 5,2·10-2; из справочника для аммиаката меди [Cu(NH3)4]2+ b1 = 1,3·104; b2 = 4,1·107; b3 = 3,0·1010; b4 = 3,9·1012. Тогда по (2.6) и (2.5):
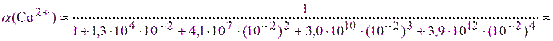
= 1,4·10-5 и K”(CuY2-) = 6·1018·1,4·10-5·5,2·10-2 = 4,4·1012> 108.
Количественное определение меди в указанных условиях возможно.
3. Расчет кривой комплексонометрического титрования
В комплексонометрическом титровании для определения конечной точки титрования (КТТ) используют специальные металлохромные индикаторы (металлоиндикаторы), образующие с ионами металла менее прочные, чем титрант, комплексы, цвет которых отличается от цвета свободного индикатора. Для того, чтобы правильно выбрать металлохромный индикатор, проводят расчет кривой комплексонометрического титрования, то есть определяют изменение концентрации ионов металла от количества добавленного титранта (расчет проводят с учетом разбавления). Кривые титрования строят в координатах рМ ¸ V или рМ ¸ Р, где рМ = -lg[Mn+]; V – объём добавленного титранта, мл; Р – степень оттитрованности ионов металла, %.
Приведем расчет кривой титрования ионов металла раствором ЭДТА (трилона Б).
До точки эквивалентности концентрацию свободных ионов металла с достаточным приближением (без учета ионов металла, образующихся при диссоциации комплексона MYn-4) можно вычислить по формуле:
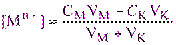 (3.1)
(3.1)
где СМ и СK – исходные молярные концентрации растворов иона металла и комплексона, моль/л; VM и VK – объёмы растворов ионов металла и комплексона в данный момент титрования, мл.
Если пользоваться понятием степени оттитрованности Р (%):
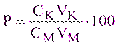 (3.2)
(3.2)
получим:
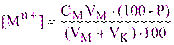 (3.3)
(3.3)
В точке эквивалентности расчет [Mn+] проводим исходя из условной константы устойчивости комплексоната при заданном значении рН (2.3). Так как в точке эквивалентности [Mn+] = C(Y), а[MYn-4] = CMVM/(VM+ VK), получим:
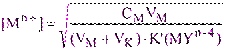 (3.4)
(3.4)
Поскольку при этом CMVM= CKVK, то:
 (3.5)
(3.5)
После точки эквивалентности [Mn+] также рассчитывается из выражения для условной константы устойчивости (2.3):
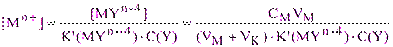 (3.6)
(3.6)
Оценивая избыток свободного комплексона (без учета диссоциации комплексоната) как:
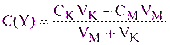 (3.7)
(3.7)
получим:
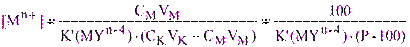 (3.8)
(3.8)
Пример 3. Рассчитать скачок (±0,1%) и рСа в точке эквивалентности на кривой титрования 0,01 М раствора хлорида кальция 0,01 М раствором трилона Б при рН=9.
Решение. Из табл.1 lgK(СаY2-) = 10,7, т.е. K(СаY2-) = 5·1010, а из табл.2 при рН=9 a(Y4-) = 5,2·10-2. Тогда по (2.3) K’(СаY2-) = 5·1010·5,2·10-2= 2,6·109.
а) Точка начала скачка Р = 99,9%. Пусть V(CaCl2) = VM= 100 мл, тогда V(H2Y2-) = VK= CMVMP/100CK = 0,01·100·99,9/100·0,01 = 99,9 мл. Из выражения (3.3) находим:
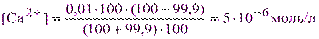 и рСа = 5,30
и рСа = 5,30
б) Точка эквивалентности Р = 100%. Из выражения (3.5) получим:
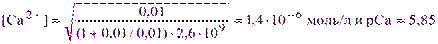
в) Точка конца скачка Р = 101,1%. Из выражения (3.8) следует, что:
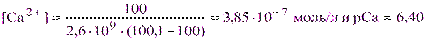
Величина скачка на кривой данного титрования составит: DрСа = 6,40 – 5,30 = 1,10.
При расчете кривой комплексонометрического титрования с учетом дополнительного комплексообразования учитывается коэффициент конкурирующей реакции a(Mn+), который рассчитывается по уравнению (2.6). При этом до точки эквивалентности равновесная концентрация ионов металла равна произведению общей концентрации несвязанного с комплексоном металла С(М) на этот коэффициент, а в точке эквивалентности и после неё расчет производится по уравнениям (3.5) и (3.8) с помощью условной константы K” (2.5).
Пример 4. Рассчитать скачок (±0,1%) и рСu в точке эквивалентности на кривой титрования 0,01 М раствора сульфата меди 0,01 М раствором трилона Б при рН=9 (0,01 М аммонийная буферная смесь).
Решение. Из табл.1 lgK(СuY2-) = 18,8, т.е. K(СuY2-) = 5·1010, а из табл.2 при рН=9 a(Y4-) = 5,2·10-2; из справочника для аммиаката меди [Cu(NH3)4]2+ b1 = 1,3·104; b2 = 4,1·107; b3 = 3,0·1010; b4 = 3,9·1012. Тогда по (2.6) и (2.5):
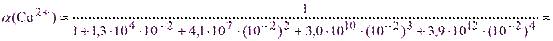
= 1,4·10-5 и K”(CuY2-) = 6·1018·1,4·10-5·5,2·10-2 = 4,4·1012.
а) Точка начала скачка Р = 99,9%. Пусть V(CuSO4) = VM= 100 мл, тогда V(H2Y2-) = VK= CMVMP/100CK = 0,01·100·99,9/100·0,01 = 99,9 мл. Используя выражение (3.3) находим:
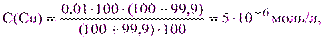
тогда [Cu2+] = 5·10-6·1,4·10-5= 7·10-11 и рСu = 10,15
б) Точка эквивалентности Р = 100%. При этом С(Cu) = С(Y) и из уравнений (3.5) и (2.5) получим:
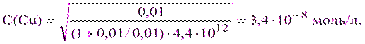
тогда [Cu2+] = 3,4·10-8·1,4·10-5= 4,8·10-13 и рСu = 12,32
в) Точка конца скачка Р = 101,1%. Из выражений (3.8) и (2.5) следует, что:
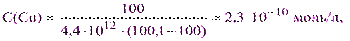
тогда [Cu2+] = 2,3·10-10·1,4·10-5= 3,2·10-15 и рСu = 14,50
Величина скачка на кривой данного титрования составит: DрСu = 14,50 – 10,15 = 4,35.
Форма кривой комплексонометрического титрования аналогична кривым титрования в других методах титриметрии (килотно-основном, окислительно-восстановительном, осадительном), то есть на кривой наблюдается резкое изменение рМ вблизи точки эквивалентности – скачок титрования.
Величина скачка зависит:
1. от прочности образующегося комплексоната - чем больше константа устойчивости, то есть чем прочнее комплексонат, тем больше скачок (рис.1);
2. от кислотности среды – чем она выше, то есть чем меньше значение рН, тем меньше скачок; в кислой среде при титровании ионов металлов, образующих малоустойчивые комплексонаты (например, Ba2+, Mg2+, Ca2+) скачок на кривой титрование отсутствует и определение невозможно (рис.2);
3. от концентрации реагирующих веществ – чем больше концентрация титранта и определяемого иона, тем больше скачок; например, при титровании 0,01 М раствора CaCl2 0,01 М раствором трилона Б величина скачка DрСа составляет 1,1 (см. пример 3), а при использовании 0,1 М растворов – 3,1 единицы;
4. от присутствия дополнительных комплексообразователей – чем их больше, тем меньше скачок.
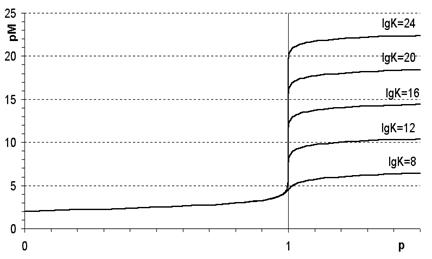
Рис.1. Зависимость величины скачка на кривой комплексонометрического титро-
вания от прочности образующегося комплексоната
Р 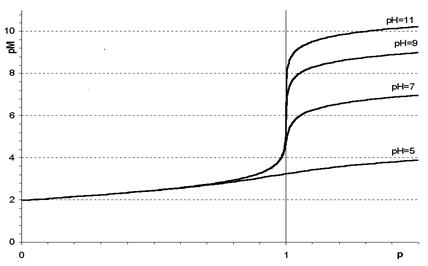
ис.2. Зависимость величины скачка на кривой комплексонометрического титро-
вания ионов Са2+комплексоном от рН раствора
3. Металлохромные индикаторы, механизм их действия и рациональный выбор
В большинстве случаев конечную точку титрования в комплексонометрии устанавливают с помощью металлохромных индикаторов (металлоиндикаторов), которые представляют собой органические вещества (красители), образующие с ионами металлов окрашенные комплексные соединения, менее устойчивые по сравнению с их комплексонатами. Образующиеся комплексы отличаются по цвету от свободных ионов или молекул индикатора. Рассмотрим свойства некоторых наиболее распространенных металлохромных индикаторов.
Эриохром черный Т (хромоген черный специальный ЕТ = 00) является азокрасителем, обладающим свойствами слабой трехосновной кислоты (H3Ind):
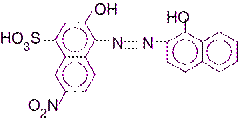
Эриохром черный Т при возрастании рН раствора переходит из одной окрашенной формы в другую в соответствии со следующей схемой:
H2Ind- «HInd2- «Ind3-
pH<6 6<pH<11 pH>11
красный синий оранжевый
Преобладание той или иной формы индикатора определяется величинами его констант кислотной диссоциации и значением рН раствора. При рН = 6-11 доминирующим будет ион HInd2-, окрашенный в синий цвет. В этом интервале рН большинство ионов металлов образуют с эриохромом черным Т комплексы состава 1:1 фиолетового цвета:
Mn++ HInd2- «MIndn-3+ H+
Координационные связи в комплексе образуются за счет атомов азота азогруппы и атомов кислорода депротонированных фенольных групп. В процессе титрования раствором ЭДТА вблизи точки эквивалентности происходит вытеснение индикатора комплексоном из внутренней сферы комплекса с образованием бесцветного комплексоната и окрашенной в синий цвет формы свободного индикатора HInd2-:
MIndn-3+ H2Y2- «MYn-4+ HInd2-+ H+
фиолетовый бесцветный синий
Таким образом, при титровании ионов металлов трилоном Б в нейтральной и слабощелочной среде в присутствии эриохрома черного Т переход окраски индикатора от фиолетовой к синей указывает на конечную точку титрования, которая с определенной степенью точности близка к точке эквивалентности. Как правило, комплексонометрическое титрование с эриохромом черным Т проводят в присутствии аммонийной буферной смеси (рН ~ 9); в кислой (рН < 6) и сильнощелочной (рН > 11) средах этот металлохромный индикатор не применяют, так как в этих условиях затруднено определение перехода окраски от фиолетовой к красной или оранжевой. В практике анализа используют 0,05-0,5% спиртовые растворы индикатора или более устойчивую при хранении сухую смесь с хлоридом натрия.
Кислотный хромовый темно-синий (кислотный хромовый синий Т):
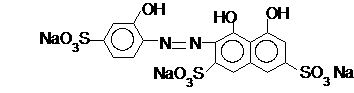
В растворах в зависимости от рН среды находится различных формах – H3Ind3- и H2Ind4-(в кислой среде), HInd5-(в нейтральной среде), Ind6-(в щелочной среде). При рН > 9 свободный индикатор окрашен в синий цвет, а его комплексы с ионами металлов - в красный. Применяется в виде 0,1% спиртового раствора для определения при рН = 9-10 ионов Zn2+, Mn2+, Mg2+, Pb2+, Ca2+. Последний может быть определен и при рН = 12, что позволяет использовать этот индикатор при определении кальциевой жесткости воды.
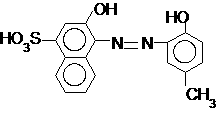
К азокрасителям относятся и другие индикаторы – близкий к эриохрому по строению и свойствам, но более устойчивый в растворе, кальмагит:
а также пиридилазорезорцин (ПАР) и пиридилазонафтол (ПАН):
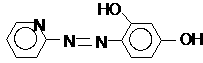
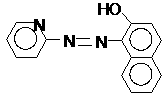
ПАР ПАН
ПАР и ПАН связывают ионы металлов как через атом кислорода фенольной группы, так и через атомы азота азогруппы и пиридинового кольца. В нейтральной или слабокислой среде (рН = 3-5) эти индикаторы имеют желтый цвет, а их комплексы с ионами металлов – красный или фиолетовый. На практике применяют 0,05-0,2% водные или спиртовые растворы индикаторов при титровании ионов марганца, никеля, свинца, цинка, кадмия, меди в среде ацетатного буферного раствора.
При комплексонометрическом титровании в кислой среде используют металлохромные индикаторы, относящиеся к трифенилметановым красителям – пирокатехиновый фиолетовый (ПФ) и ксиленоловый оранжевый (КО).
Пирокатехиновый фиолетовый является слабой трехосновной кислотой. Свободный индикатор при рН = 2-6 имеет желтую окраску, в то время как его комплексы с ионами металлов окрашены в синий цвет. Применяется в виде 0,1% спиртового раствора для определения металлов, образующих высоко устойчивые комплексонаты (lgK > 18) – Bi3+, Fe3+, Ce4+, Cu2+, Pb2+ и др. Может использоваться и в слабощелочной среде при рН = 9-10 для титрования Cd2+, Co2+, Mg2+, Mn2+, Ni2+, Zn2+; при этом изменение окраски от синей к красной.
Ксиленоловый оранжевый - слабая шестиосновная кислота. Свободный индикатор при рН < 6 имеет желтую окраску, в то время как его комплексы с ионами металлов окрашены в красный цвет. Применяется в виде 0,1% спиртового раствора для определения Bi3+, Fe3+, Ce4+(рН = 1-3) и Cu2+, Pb2+, Cd2+, Co2+, Ni2+, Zn2+, Hg2+(рН = 4-6).
Мурексид – аммонийная соль пурпуровой кислоты. Образует комплексы с рядом катионов в нейтральной и щелочной среде. Чаще всего мурексид применяют для определения кальция в сильнощелочной среде (рН > 11). При этом свободный индикатор окрашен в фиолетовый цвет, а комплекс кальция с ним в красный. Индикатор применяют в виде 1% водного раствора или в виде сухой смеси с сахарозой (или хлоридом натрия) в соотношении 1:500.
Как было показано выше, в основе комплексонометрического титрования с металлохромным индикатором (например, типа H3Ind – эриохром черный Т) в буферной среде лежит реакция:
MIndn-3+ H2Y2- «MYn-4+ HInd2-+ H+
При этом необходимо, чтобы комплексон вытеснял индикатор из его комплекса с металлом в процессе титрования при данном значении рН, то есть чтобы условная константа устойчивости комплексоната была больше соответствующей константы комплекса металла с индикатором: K’(MYn-4) > K’(MIndn-3). Понятие «условная константа устойчивости» для комплекса металла с индикатором при заданном рН обусловлено теми же соображениями, что и для комплексонатов с ЭДТА, а именно, наличием в растворе различных по степени протонирования форм индикатора. Тогда:
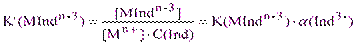 (4.1)
(4.1)
где: K(MIndn-3) – истинная константа устойчивости (из справочника);
C(Ind) = [H3Ind] + [H2Ind-] + [HInd2-] + [Ind3-] – общая концентрация несвязанного в
комплекс индикатора, моль/л;
a(Ind3-) = [Ind3-]/C(Ind) – мольная доля ионов Ind3- в общей концентрации свободно-
го индикатора.
Величина K’(MIndn-3) должна быть меньше условной константы устойчивости комплексоната металла примерно в 10-100 раз, так как только в этом случае изменение окраски индикатора в наибольшей степени соответствует истинному положению точки эквивалентности. Большее значение K’(MIndn-3) приводит к перетитровыванию (завышению результата), а меньшее – к недотитровыванию (занижению результата), то есть к увеличению индикаторной погрешности, которая определяется несовпадением конечной точки титрования (КТТ), фиксируемой по изменению окраски индикатора, с точкой эквивалентности (ТЭ).
Из выражения для условной константы устойчивости комплекса с индикатором (4.1) находим:
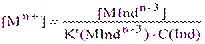 (4.2)
(4.2)
или:
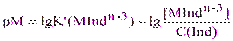 (4.3)
(4.3)
Интервал перехода окраски (ИПО) индикатора устанавливают в пределах изменений соотношения [MIndn-3]/C(Ind) от 1/10 до 10/1, то есть в границах преобладания окраски одной из форм индикатора, тогда:
ИПО = DрМ = lgK’(MIndn-3) ± 1 (4.4)
Точка перехода индикатора из комплекса в свободное состояние, соответствующая наиболее заметному изменению цвета раствора (конечная точка титрования), наблюдается при равенстве концентраций комплекса и свободного индикатора и называется показателем титрования с данным металлохромным индикатором pТM:
рМ = lgK’(MIndn-3) = рТM(4.5)
Другими словами, показатель титрования в комплексонометрии рТМ соответствует концентрации свободных ионов металла в конечной точке титрования 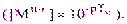
При подборе индикатора для комплексонометрических определений необходимо, чтобы значение его показателя рТМ попадало в область скачка на кривой титрования и было максимально приближено к расчетной точке эквивалентности (Р = 100%). В этом случае величина индикаторной погрешности будет минимальной.
5. Индикаторная погрешность при комплексонометрическом титровании
Возникновение индикаторной погрешности в комплексонометрии связано с тем, что изменение цвета металлохромного индикатора не происходит точно в точке эквивалентности, то есть конечная точка титрования не совпадает с точкой эквивалентности. При этом величина относительной индикаторной погрешности (e, %) определяется из выражения:


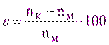 (5.1)
(5.1)
где: nк – количество добавленного комплексона в конечной точке титрования, моль;
nм – исходное количество определяемого металла, моль.
Если nк> nм, то погрешность имеет положительный знак, что соответствует перетитровыванию раствора; при nк< nм знак погрешности отрицательный и раствор недотитрован.
Из уравнений материального баланса в конечной точке титрования при отсутствии дополнительного комплексообразования имеем:
nк = n(Y) + n(MYn-4) (5.2)
nм= n(Mn+) + n(MYn-4) (5.3)
Тогда, подставив (5.2) и (5.3) в (5.1), получим:
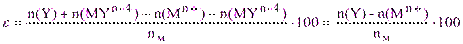 (5.4)
(5.4)
или:
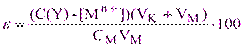 (5.5)
(5.5)
Выразив из (2.3) величину C(Y) и подставив её в (5.5), получим:
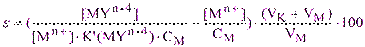 (5.6)
(5.6)
Так как вблизи точки эквивалентности n(MYn-4) @ nм, то есть [MYn-4]·(VK+ VM) @ CMVM, то в конечной точке титрования:
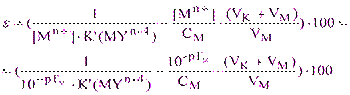 (5.7)
(5.7)
Анализ полученной формулы (5.7) показывает, что индикаторная погрешность равна нулю, если конечная точка титрования совпадает с точкой эквивалентности, то есть рТМ = рМТЭ.
Если рТМ>> рМТЭ (индикатор меняет свою окраску после точки эквивалентности, раствор перетитрован), то равновесная концентрация ионов металла [Mn+] в конечной точке титрования настолько мала, что величиной 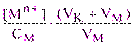 можно пренебречь, и индикаторная погрешность определяется первым членом уравнения (5.7):
можно пренебречь, и индикаторная погрешность определяется первым членом уравнения (5.7):
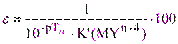 (5.8)
(5.8)
При этом, чем больше условная константа устойчивости комплексоната, тем меньше погрешность титрования с данным индикатором
Если конечная точка титрования лежит до точки эквивалентности (рТМ << pMТЭ), то индикаторная погрешность определяется вторым членом уравнения (5.7):
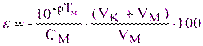 (5.9)
(5.9)
При этом знак погрешности отрицательный (раствор недотитрован) и она тем меньше, чем больше исходная концентрация определяемого металла.
Пример 5. Рассчитать индикаторную погрешность при титровании 0,01 М раствора MgCl20,01 М раствором трилона Б с металлохромным индикатором эриохромом черным Т при рН = 9.
Решение. Из табл.1 lgK(MgY2-) = 8,7, т.е. K(MgY2-) = 5·108, а из табл.2 при рН=9 a(Y4-) = 5,2·10-2.Тогда по (2.3) K’(MgY2-) = 5·108·5,2·10-2= 2,6·107.
Из выражения (3.5) в точке эквивалентности имеем:
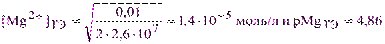
Из справочника lgK(MgInd-) = 7, то есть K(MgInd-) = 1·107. При рН=9 металлоиндикатор эриохром черный Т находится преимущественно в формах Ind3-, HInd2- и H2Ind-; нейтральная молекула индикатора H3Ind практически отсутствует. Константы кислотной диссоциации для протонированных форм равны Ka2= 5·10-7 и Ka3= 2,5·10-12. Тогда по формуле аналогичной (2.2’) получим:
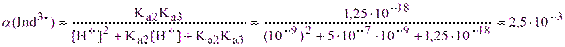
Из уравнений (2.3) и (4.5) имеем: K’(MgInd-) = 1·107·2,5·10-3= 2,5·104 и рТМg = 4,40. Из выражения (5.7) рассчитываем индикаторную погрешность:
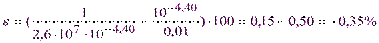
Раствор недотитрован (pTMg< pMgТЭ).
Если титровать децимолярный раствор хлорида магния, то pTMg> рMgТЭ= 4,36и раствор будет немного перетитрован (e = +0,10%).
Аналогично проводятся расчеты относительной индикаторной погрешности и при наличии дополнительного комплексообразования, но при этом в уравнении (5.7) используется условная константа устойчивости K”(MYn-4) (2.5), учитывающая этот процесс.
Date: 2015-09-24; view: 5825; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |