
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Свойства d-элементов VI группы
Электронные конфигурации атомов. Валентные возможности и степени окисления. Закономерности в изменении величин радиусов атомов, энергий ионизации, устойчивости состояний высшей степени окисления, окислительно-восстановительной активности. Способность к комплексообразованию, координационное число. Карбонилы.
Получение хрома, молибдена, вольфрама.
Хром. Отношение хрома к кислороду, неметаллам, кислотам. Кислотно-основный характер оксидов и гидроксидов хрома (II, III, VI), способы их получения. Амфотерный характер оксида и гидроксида хрома (III).
Соединения хрома (II, III), способы их получения, свойства. Гидролиз солей хрома (II, III). Хромиты.
Оксид хрома (VI), его свойства. Хромовые кислоты. Хроматы и дихроматы, их получение, окислительные свойства. Взаимные переходы солей хрома (III, VI). Оксогалиды – хлорид диоксохрома (VI) (хлористый хромил). Хлорохромовая кислота.
Молибден, вольфрам. Отношение к неметаллам, кислотам, щелочам. Кислотно-основный характер оксидов и гидроксидов молибдена и вольфрама. Молибдаты и вольфраматы, способы получения и свойства.
Понятие о кластерных соединениях на примере галидов молибдена и вольфрама.
Вопросы и задачи:12, с. 16, № 1–76.
1. В каком соотношении следует смешать 20%-ный раствор NaOH и 10%-ный раствор H2CrO4, чтобы получить нейтральный раствор?
(Ответ: V (NaOH): V (H2CrO4) = 20: 59)
2. Можно ли использовать уголь для восстановления хрома из его оксида? Провести термодинамические расчеты и указать интервал температур, при которых данный процесс термодинамически возможен. (Ответ: процесс возможен при Т > 1980,3К)
3. В какую сторону сместится равновесие 2CrO42-–+ 2H+ + 3e– ↔ Cr2O72– + H2O при добавлении к раствору нитрата серебра? Ответ мотивировать.
4. Во сколько раз различается растворимость хромата серебра в воде и в 0,1 М растворе хромата натрия? (Ответ: в воде выше в 31,4 раза)
5. Вычислить рН 0,01 М раствора нитрата хрома (III). Чему равна степень гидролиза данной соли? (Ответ: рН = 6; h = 0,01%)
6. При какой концентрации K2CrO4 начнется выпадение осадка хромата серебра из 0,2 М раствора [Ag(NH3)2]Cl, содержащего 0,1 моль аммиака в 1 л раствора?
(Ответ: С = 1,168 моль/л)
7. Закончить уравнения реакций. Для а) определить D G 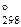 реакции: а) K2Cr2O7+SO2+HCl→; б) K2CrO4+H2O2+KOH→. (Ответ: D G
реакции: а) K2Cr2O7+SO2+HCl→; б) K2CrO4+H2O2+KOH→. (Ответ: D G 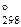 = 671,64 кДж)
= 671,64 кДж)
8. Вычислить значение окислительно-восстановительного потенциала системы Cr3+ + e– = Cr2+ для случая, когда C(Cr2+) = 0,01 моль/л и C(Cr3+) = 0,001 моль/л (Т = 298 К).
(Ответ: D Е 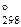 = –0,469 В)
= –0,469 В)
9. Составить схемы и рассчитать ЭДС при стандартных условиях двух гальванических элементов, в одном из которых хром является анодом, в другом – катодом.
10. Используя значения стандартных окислительно-восстановительных потенциалов, сравнить окислительные свойства CrO42– в кислой и щелочной средах.
Литература: 1, с. 597–618; 2, с. 507–521.
Date: 2015-09-24; view: 472; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |