
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Условные показатели качества питьевой воды
ТЕОРЕТИЧЕСКИЙ ОБЗОР
Вода, которую мы потребляем, должна быть чистой. Качество воды определяется также по наличию в ней химических включений, которые раньше всего обнаруживают наши органы чувств: обоняние, зрение. Так, микрочастицы меди придают воде некоторую мутность, железа – красноту.
Условные показатели качества питьевой воды
1. Химические-наиболее распространенные загрязнители воды железо, марганец, сульфиды, фториды, соли кальция и магния, органические соединения, др.
2. Органолептические- это вкусовые показатели: запах, цвет, мутность.
3. Токсикологические- контролируют отсутствие или наличие в воде в пределах допустимых норм таких опасных веществ как фенолов, свинца, алюминия, мышьяка, пестицидов.
4. Микробиологические. По ним производят определение отсутствия в воде опасной микрофлоры.
5. Общие, в первую очередь влияющие на органолептику воды. С их помощью определяются такие параметры как общая жёсткость, отсутствие нефтепродуктов, допустимые пределы по: железу, нитратам, марганцу, кальцию, магнию, сульфидам.
Жёсткость воды- этосовокупность свойств, обусловленных содержанием в воде ионов Са2+ и Mg2+. Суммарная концентрация ионов Ca2+ (кальциевая Ж. в.) и Mg2+ (магниевая Ж. в.) называется общей жесткость, она образуется из двух видов жесткости: Жоб =Жвр. +Жпост.
· Жвр- временная (карбонатная) жёсткость- обусловлена гидрокарбонатами кальция и магния (Са(НСО3)2; Mg(НСО3)2),устраняется обычным кипячением;
· Жпост - постоянная (некарбонатная) жёсткость, вызвана присутствием других солей, не выделяющихся при кипячении воды: в основном, сульфатов и хлоридов Са и Mg (CaSO4, CaCl2, MgSO4, MgCl2).
Формула расчета жесткости:
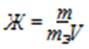
m – масса вещества, обусловливающего жесткость воды или применяемого для устранения жесткости воды, мг;
V –объем воды, л.
mЭ молярная масса эквивалента этого вещества.
Эквивалентная масса соли равна сумме эквивалентных масс металла и кислотного остатка. Ещё рассчитывается как мольная масса соли, делённая на число атомов металла, умноженных на валентность этого металла.
Типы воды (по жесткости):
· Очень мягкие0-1,5 мг-экв/л;
· Мягкие 1,5- 3,0 мг-экв/л
· Среднежесткие 3,0-4,5мг-экв/л;
· Довольно жесткие4,5-6,5мг-экв/л;
· Жесткие - 6,5 - 11,0 мг-экв/л;
· Очень жесткие - свыше 11,0 мг-экв/л
| ПРАКТИЧЕСКАЯ ЧАСТЬ | ||||||
| Опыт №1 Исследование воды на содержание примесей | ||||||
| Для исследования возьмем водопроводную воду и исследуем на наличие: · мутности, прозрачности (с помощью линейки) до и после фильтрования. · на наличие ионов железа,прилив по 1-2 капли желтой кровяной соли NH4CNS(красной кровяной соли К4[Fe(CN)6].) до и после фильтрования. · вскипятим воду в течении нескольких минут, к полученному осадку прилить несколько капель серой кислоты. Какая жесткость была устранена? | Наблюдали: | ................................................................................................................................................................................................................................................................................................ | ||||
 .. ..
| .......................................................... .............................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................. | |||||
| Опыт №2 Очистка воды в природных условиях | ||||||
| Для исследования возьмем воду из природного источника и будем очищать её с помощью следующих методов: · в первый стакан воды - добавить 1-2 капли раствора КМnO4 · во второй стакан -добавить 1-2 капли раствора йода · Оцените запах и цвет растворов. | Наблюдали: | ................................................................................................................................................................................................................................................................................................ | ||||
| ............................................................................................................................................................................................................................................................ | |||||
| Опыт №3 Определить тип жесткости воды | ||||||
| Задание: 1. Вычислите жесткость воды, зная, что в 500 л ее содержится 202,5 г Са(НСО3)2.Определить тип жесткости воды. | Дано: ............................................................................................ Найти:..................... | Решение: ................................................................................................................................................................................................................ | ||||
| Вывод:............................................................................ | ||||||
| Опыт №4 Определить массу соли образующую жесткую воду | ||||||
| Задание: Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 7 ммоль? | Дано: ............................................................................................ Найти:..................... | Решение: ................................................................................................................................................................................................................ | ||||
| Вывод:............................................................................ | ||||||
Общий вывод:................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................................
Лабораторная работа №7
Тема: Реакции ионного обмена, идущие необратимо.
Цель: Научиться практически выполнять реакции ионного обмена (РИО), идущие необратимо и записывать эти реакции в ионно-молекулярных формах.
Теоретический обзор
Реакции, протекающие в растворах между ионами, называют ионными реакциями.
Реакции ионного обмена не сопровождается изменением заряда ионов (степени окисления атомов) реагирующих веществ. Возможно два варианта исхода РИО:
а) реакция идет обратимо; б) реакция идет необратимо.
Реакции ионного обмена идут в соответствии со схемой:
AB + CД à АД + ВС
Они записываются в трех формах: -в молекулярной;
- в полной ионно-молекулярной;
-в сокращенной ионно-молекулярной.
Реакция ионного обмена протекает необратимо в трех случаях, когда образуется:
1. Трудно растворимое соединение – осадок.
2. Газообразные вещества (H2S, CO2, NH3 и т.д.)
3. Малодиссоциирующих веществ (Н2О, НСN, Н3РО4, HNO2, СН3 СООНи т.д.)
ВНИМАНИЕ! Нестойкие соединения.
NH4OH→ NH3 + H2O
H2CO3 → CO2 + H2O
H2SO3 → H2O + SO2
Date: 2015-09-05; view: 495; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |