
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Ионные реакции
УХТИНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
ИОННЫЕ РЕАКЦИИ
Методические указания к самостоятельной работе
студентов и лабораторному практикуму по химии
для студентов всех специальностей
Ухта 2004
УДК 546(075)
Х 15
Хаин В.С. Ионные реакции: Методические указания / В.С. Хаин, В.И. Крупенский.-Ухта: УГТУ, 2004.- 10 с.
Методические указания предназначены для выполнения лабораторных работ по дисциплине химия для студентов 1 курса всех специальностей.
Методические указания содержат описание лабораторной работы - ход его выполнения, обработка результатов, составление отсчета.
Содержание методических указаний соответствует рабочей учебной программе.
Методические указания рассмотрены и одобрены кафедрой химии от 11 ноября 2004 г., пр.№2 и предложены для издания Советом специальности ЭАП от 25 ноября 2004 г. пр. № 10.
Рецензент Кустова В.В., к.п.н., доцент кафедры химии.
Редактор Рудиченко Н.В.
В методических указаниях учтены предложения и замечания рецензента и редактора.
План 2004 г., позиция 51.
Подписано в печать 10 декабря 2004 г. Компьютерный набор.
Объем 10 с. Тираж 100 экз. Заказ № 186.
Ó Ухтинский государственный технический университет, 2004.
169300, г. Ухта, ул. Первомайская, 13.
Отдел оперативной полиграфии УГТУ.
169300, г. Ухта, ул. Октябрьская, 13.
ИОННЫЕ РЕАКЦИИ
Цель работы. Изучение условий протекания реакций ионного обмена.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Согласно теории электролитической диссоциации (С.А. Аррениус, 1887 г.) свойства растворов электролитов объясняются обратимым распадом молекул электролитов на ионы под влиянием молекул растворителя - электролитической диссоциацией. Полнота процесса электролитической диссоциации характеризуется степенью диссоциации (a), которая выражается в долях единицы или процентах:

По величине a судят о силе электролита:
| Электролит | Степень диссоциации, α | Представители |
| 1. Сильные электролиты | a>30 % | - кислоты: HCl, HBr, HI, HNO3, H2SO4, HClO4, HMnO4; - основания щелочных и щелочно-земельных металлов: NaOH, KOH, Ca(OH)2, Ba(OH)2; - почти все соли, кроме HgCl2, Hg(CH3COO)2; - большинство комплексных соединений |
| 2. Электролиты средней силы | 5<a<30 % | H3PO4, H3PO3, H2SO3, H2CrO4, H2F2,, H2S2O3 |
| 3. слабые электролиты | a<5 % | - кислоты: H2S, H2CO3, HCN,,большинство органических кислот; - основания: гидроксиды металлов со степенью окисления 2+ и более, NH4OH; - вода также является слабым электролитом |
Для слабых и средней силы электролитов в растворе устанавливается равновесие между образовавшимися ионами и оставшимися молекулами. Поэтому способность слабого электролита диссоциировать на ионы, т.е его силу, можно характеризовать величиной константы равновесия процесса.
Например, для некоего вещества АВ, обратимо диссоциирующего на катион А+ и анион В- по схеме:
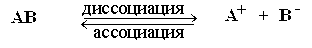
при установившемся равновесии на основании закона действующих масс можно записать

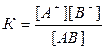 ,
,
где К – константа равновесия, называемая константой диссоциации;
[A+] и [B-] – концентрации ионов в состоянии равновесия, моль/л;
[AB] – концентрация молекул растворенного вещества, находящихся в равновесии с ионами, моль/л.
Чем ниже величина константы диссоциации, тем слабее электролит.
Величина константы диссоциации зависит от температуры и не зависит от концентрации раствора.
В приложении практического руководства приведена таблица констант диссоциации некоторых слабых электролитов (табл.1.).
Если в растворе смешиваются два электролита, то реакция между ними возможна только в том случае, когда равновесие процесса будет смещено вправо. Это происходит при связывании ионов исходных электролитов в следующих случаях.
1. Если продуктом реакции является слабодиссоциирующий электролит. Например, слабый электролит:
a) HCl + NaOH = H2O + NaCl
или в краткой ионно-молекулярной форме
H+ + OH- = H2O
b) или комплексный ион:
AlCl3 + 6KOH = K3 [Al(OH)6] + 3KCl
Al3+ + 6OH- = [Al(OH)6]3-
2. Если продуктом реакции является летучее (газообразное) вещество. Например:
Na2S + H2SO4 = H2S↑ + Na2SO4
S2- + 2H+ = H2S↑
3.Если продуктом реакции является малорастворимое вещество (выпадает осадок). Например:
BaCl2 + Na2SO4 = BaSO4↓ + 2NaCl
Ba2+ + SO42- = BaSO4↓
Таким образом, реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных, наименее растворимых или газообразных веществ.
О возможности протекания ионных реакций в указанном направлении свидетельствуют и термодинамические расчеты.
Так, для реакций между любыми сильными основаниями и любой сильной кислотой (реакция нейтрализации), суть которых сводится к взаимодействию ионов H+ и OH-
H+(p) + OH-(p) = H2O(p)
значение энергии Гиббса DG°298 = –79,9 кДж.
Для реакции:
BaCl2(p) + Na2SO4(p) = BaSO4¯ + 2NаCl(p)
сущность которой выражается ионно-молекулярным уравнением
Вa2+(p) + SO42-(p) = BaSO4(к)
значение энергии Гиббса DG°298 = –60 кДж.
Для реакции
Na2SO3(p) + 2HCl(p) = 2NaCl(p) +SO2(р) + H2O(p)
сущность которой выражается уравнением
SO32-(p) + 2H+(p) = SO2(p) + H2O(p)
значение энергии Гиббса DG°298 = –51 кДж.
Эти примеры говорят о том, что ионообменные реакции протекают с убылью энергии Гиббса.
При составлении ионно-молекулярных уравнений следует помнить, что
1) в ионно-молекулярных уравнениях в ионном виде записывают, как правило, только формулы сильных электролитов;
2) в кратких ионно-молекулярных уравнениях записывают формулы только тех частиц (ионов, молекул, комплексов), которые принимают участие в формировании слабодиссоциирующих, газообразных или малорастворимых веществ;
2) слабодиссоциирующие, газообразные или малорастворимые вещества записывают в форме молекул (или комплексных ионов).
При осуществлении реакций, в результате которых получается малорастворимое вещество, следует помнить, что осадок выпадает лишь в том случае, если произведение концентрации ионов равно или больше произведения растворимости данного соединения.
Произведением растворимости (ПР) называется произведение концентрации ионов в насыщенном растворе трудно растворимого электролита в степенях стехиометрических коэффициентов. Это величина при данной температуре является постоянной.
В приложении данного руководства приводится таблица ПР некоторых малорастворимых в воде веществ при 25°С (табл. 2).
Пример 1. Необходимо выяснить, выпадает ли осадок CaSO4 если концентрация раствора сульфата кальция равна 10-3 моль/л.
Решение.
1. Определяют произведение концентраций ионов Ca2+ и SO42- в данном растворе
 CaSO4 «Ca2+ + SO42-
CaSO4 «Ca2+ + SO42-
[ SO42-] = [ Ca2+] = 10-3 моль/л
[SO42-] × [ Ca2+] = 10-3 × 10-3 = 10-6
2. Сравнивают полученное значение с ПРCaSO4 (см. табл. 2). Так как ПРCаSO4 = 1,3×10-4, а полученное произведение ионов 1×10-6, то осадок в данном случае образоваться не может, т.к раствор CaSO4 будет ненасыщенным.
Пример 2. Произойдет ли осаждение малорастворимого AgNO2 (ПРAgNO2=1,6×10-4) при смешивании равных объемов 0,2 М растворов AgNO3 и KNO2?
Решение.
Происходящая реакция выразится уравнением
AgNO3 + KNO2 = AgNO2 + KNO3
Соли диссоциируют по уравнениям
AgNO3 → Ag+ + NO3-
KNO2 → K+ + NO2-
Следовательно, концентрация иона Ag+ будет равна концентрации раствора AgNO3, а концентрация иона NO2-- концентрации раствора KNO2.
Тогда
[Ag+] × [ NO2-] = 0,2×0,2 = 4×10-2
Эта величина больше ПРAgNO2, поэтому в данном случае выпадает осадок AgNO2.
Так как ПР – величина постоянная при данной температуре, то введение в раствор одноименных ионов будет смещать равновесие в системе осадок-раствор в сторону образования осадка. Так, при прибавлении хорошо растворимого BaCl2 к насыщенному раствору BaSO4 концентрация Ba2+ возрастает. Это приведет к связыванию ионов SO42-, т.е. к образованию осадка.
Чем больше величина ПР, тем легче добиться растворения осадка. Если AgI (ПРAgI=8,1×10-7) не растворяется в аммиаке, то AgCl (ПРAgCl=1,8×10-7) растворим в нем, при этом образуется аммиакат серебра – комплексное соединение.
Date: 2015-07-24; view: 552; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |