
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Известкование воды
М е т о д и к а п р о в е д е н и я р а б о т ы и о б р а б о т к а
р е з у л ь т а т о в о п ы т о в
Работу выполняют в следующей последовательности:
a) производятся анализы исходной воды: общая жесткость, общая щелочность, составляющие общей щелочности, концентрация ионов кальция согласно методикам аналитического контроля, приведенных в прил. 1; данные заносятся в таблицу наблюдений (табл. 2);
б) подсчитывают дозу извести по уравнениям (7) или (11); концентрацию свободной углекислоты принимают 0,02 мг-экв/кг, а избыток извести 0,2 мг-экв/кг; затем выполняется пересчет дозы извести на имеющуюся в лаборатории концентрацию, пользуясь таблицей пересчета концентраций (Прил. 2);
в) отмеривают мерным цилиндром объем воды для опыта, составляющий 500 мл, переливают его в колбу из термостойкого стекла и нагревают на электрической плитке до 40 оС, контролируя температуру воды лабораторным термометром;
г) отфильтровывают рассчитанный объем раствора извести в мерный цилиндр, вливают требуемый объем извести в подогретую воду;
д) перемешивают содержимое колбы медленными вращательными движениями в течение 10 минут, а затем дают отстояться в течение 15 минут;
е) отфильтровывают осадок обработанной воды на бумажный фильтр;
ж) определяют в известкованной воде общую жесткость, общую щелочность, составляющие общей щелочности, концентрацию ионов кальция согласно методикам аналитического контроля, результаты заносят в таблицу наблюдений;
з) анализируют качественные и количественные показатели состава воды до и после известкования;
и) заканчивают оформление отчета.
С о д е р ж а н и е о т ч е т а
Отчет о работе должен включать:
а) краткое описание сущности технологического процесса известкования воды;
б) условия, в которых проводилось известкование;
в) расчет дозы извести, необходимой для проведения процесса;
г) рабочие записи выполненных анализов воды, в которых указывается: принятая методика определения; характеристика анализируемой воды (исходная, известкованная); объем воды, взятой для анализа; реактивы, используемые для анализа; объем растворов, затраченных на титрование; расчетные формулы с конкретным цифровым материалом;
результаты опытов оформляют в виде таблицы 2;
д) ответы на контрольные вопросы.
Таблица 2. Результаты измерений
| Исследуемая вода | Жесткость, | Щелочность, мг-экв/дм3 | |||||||||
| Общая | Кальци- евая | Магние- вая | Общая | гидратная | карбонатная | бикарбонатная | |||||
| мг-экв/дм3 | % снижения | мг-экв/дм3 | % снижения | мг-экв/дм3 | % снижения | мг-экв/дм3 | % снижения | ||||
| Исходная вода | |||||||||||
| Известкованная вода |
К о н т р о л ь н ы е в о п р о с ы
1. Цели известкования?
2. От чего зависит доза извести?
3. Для чего необходим избыток извести?
4. Как определяли необходимое количество известкового молока?
5. Какие режимы известкования Вы знаете?
6. Для какого режима известкования Вы рассчитывали дозу извести?
7. Как изменяется качество воды после известкования?
8. Как изменяется солесодержание известкованной воды?
П Р И Л О Ж Е Н И Я
Приложение 1.
МЕТОДИКИ АНАЛИТИЧЕСКОГО КОНТРОЛЯ []
1. О п р е д е л е н и е ж е с т к о с т и
Сущность метода.
Комплексонометрический метод определения общей жесткости наиболее распространен. Он основан на образовании катионами Са2+ и Мg2+ прочных внутрикомплексных соединений с трилоном Б. Трилон Б - натриевая соль этилендиаминтетрауксусной кислоты, образующая растворимые в воде внутрикомплексные соединения с катионами различных двух- и трехвалентных металлов.
Если в раствор, содержащий ионы металлов, ввести индикатор, дающий непрочное цветное соединение с ионами этого металла, то при добавлении трилона Б к такому окрашенному раствору в эквивалентной точке произойдет изменение окраски. В качестве индикатора при определении общей жесткости используются кислотный хром темно-синий, эриохром черный Т. Так, при титровании пробы воды трилоном Б в присутствии индикатора красные комплексы кальция и магния разрушаются, образуются комплексонаты этих металлов с трилоном Б, не имеющие окраски. Поэтому в точке эквивалентности красная окраска раствора переходит в синюю, обусловленную окраской аниона индикатора. Так как индикатор меняет свою окраску не только от изменения концентрации ионов кальция и магния, но и в зависимости от рН раствора, в титруемый раствор добавляют буферную смесь (NH4OH + NH4Cl), поддерживающую рН около 10.
По количеству трилона Б, пошедшего на титрование пробы воды с индикатором, рассчитывают содержание растворенных в ней солей кальция и магния. Чувствительность комплексонометрического метода определения общей жесткости практически 1 мкг-экв/дм3.
Определение. В коническую колбу вместимостью 250 мл отмеривают 100 мл исследуемой воды, добавляют 5 мл аммиачного буферного раствора и 7…8 капель индикатора – хром кислотный темно-синий. При этом раствор окрашивается в розовый цвет и сразу же титруют 0,1 н раствором трилона Б при интенсивном перемешивании до изменения розовой окраски в синюю, что соответствует эквивалентной точке связывания всех катионов кальция и магния. Замечают по делениям бюретки объем раствора трилона Б, затраченного на титрование. Окраска раствора от избытка трилона Б остается неизменной, поэтому в конце титрования рабочий раствор трилона Б следует прибавлять осторожно по каплям.
Если на титрование затрачено больше 10 мл раствора трилона Б, то опыт следует повторить, взяв для определения меньший объем пробы (50 мл) и довести пробу до 100 мл дистиллированной водой.
Для воды с общей жесткостью менее 0,5 мг-экв/дм3 следует брать 0,01н раствор трилона Б, жесткость воды будет выражаться в мкг-экв/дм3.
Общая жесткость вычисляется по формуле, мг-экв/дм3
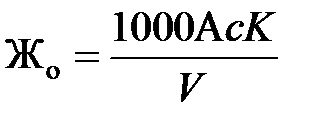 ,
,
где с – нормальность раствора трилона Б;
K – поправочный коэффициент к нормальности раствора трилона Б;
А – объем раствора трилона Б, затраченного на титрование, мл;
V – объем анализируемой пробы, мл.
2. О п р е д е л е н и е к о н ц е н т р а ц и и и о н о в к а л ь ц и я
Содержание ионов Са2+ в природных водах подвержено значительным колебаниям — от нескольких единиц до тысячи миллиграммов на литр. Основные источники Са2+ — известняковые и гипсовые породы. Ион Са2+ преобладает в мало минерализованных водах. С повышением минерализации содержание Са2+ резко снижается, что связано с малой растворимостью карбоната и сульфата кальция. Обычно кальций в природных водах содержится в форме гидрокарбонатов, сульфатов и хлоридов. Содержание Са2+ находят перманганатометрическим и комплексонометрическим методами.
Определение кальциевой жесткости производится по тому же методу, что и определение общей жесткости. Разница заключается в том, что проба воды должно быть сильно щелочная, поэтому к ней добавляют раствор NaOH, в присутствии которого ионы Mg2+практически полностью выпадают из раствора, а в качестве индикатора используют мурексид, окрашивающий щелочной раствор в присутствии ионов кальция в красный цвет, а при отсутствии ионов кальция – в лиловый.
Определение. В коническую колбу вместимостью 250 мл отмеряют 100 мл исследуемой пробы, или меньший объем, разбавленный до 100 мл, добавляют 2 мл 2н раствора NaOH и 10…15 мг сухой смеси индикатора мурексида, титруют 0,1 н раствором трилона Б при энергичном помешивании до перехода красной (малиновой) окраски в лиловую (сине-фиолетовую). Замечают по делениям бюретки объем раствора, затраченного на титрование. Содержание ионов кальция или кальциевую жесткость рассчитывают по формуле, мг-экв/дм3
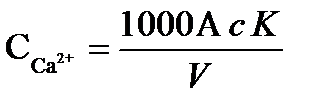 ,
,
где с – нормальность раствора трилона Б;
К – поправочный коэффициент к нормальности раствора трилона Б;
А – объем раствора трилона Б, мл;
V – объем анализируемой пробы, мл.
3. О п р е д е л е н и е щ е л о ч н о с т и в о д ы
Общая щелочность определяется количеством соляной кислоты, затраченной на титрование анализируемой пробы воды в присутствии индикаторов. Знания общей щелочности бывает иногда недостаточно для выбора метода обработки воды. Возникает необходимость определения отдельных форм щелочности.
Анализы по определению отдельных форм щелочности основаны на том, что при титровании пробы воды сильной кислотой, реакции, протекающие между кислотой и различными анионами, обусловливающими форму щелочности, заканчиваются при различных значениях рН раствора.
Титрование проводится в присутствии двух индикаторов, каждый из которых рассчитан на определенный диапазон рН. Метиловый оранжевый изменяет окраску на желтую в кислой среде при рН = 4,4, а фенолфталеин приобретает розовую окраску в щелочной среде при рН =8,3. Следует отметить, что значение рН = 8,3 обусловлено присутствием в воде ОН-групп, образующихся в процессах диссоциации и гидролиза. При анализе пробы воды на первом этапе используется фенолфталеин, а на втором – метиловый оранжевый. Щелочность по метиловому оранжевому соответствует содержанию в воде всех сильных и слабых оснований, поэтому её часто называют общей щелочностью.
Определение. В коническую колбу вместимостью 250 мл отбирают 100 мл исследуемой воды, добавляют 2-3 капли индикатора фенолфталеина. В случае появления розового окрашивания пробу титруют 0,1 н раствором HCl до обесцвечивания. Расход кислоты при титровании с фенолфталеином записывают, обозначив его через Ф. Затем в ту же самую пробу добавляют 2-3 капли индикатора метилового-оранжевого и продолжают титровать 0,1н раствором HCl до момента перехода желтой окраски в оранжевую. Суммарный расход кислоты при титровании с фенолфталеином и метиловым оранжевым обозначают М.
Общую щелочность воды подсчитывают по формуле, мг-экв/дм3
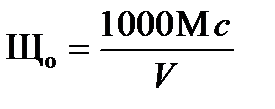 ,
,
где М – общий расход кислоты при титровании с фенолфталеином и с метиловым оранжевым, мл;
с – нормальность раствора HCl;
V – объем анализируемой пробы, мл.
Подсчет отдельных форм щелочности ведут в соответствии с полученными при титровании данными. Возможны следующие случаи:
1) фенолфталеин не дает розового окрашивания, Ф=0. В этом случае в воде присутствуют только бикарбонаты (бикарбонатная щелочность),
Щбикарб = М;
2) фенолфталеин дает розовое окрашивание, причем 2Ф < М. В этом случае в воде присутствуют как бикарбонаты, так и карбонаты,
Щбикарб = (М–2Ф), Щкарб = 2Ф;
3) фенолфталеин дает розовое окрашивание, причем 2Ф = М. В этом случае в воде присутствуют только карбонаты, Щкарб = 2Ф;
4) фенолфталеин дает розовое окрашивание, причем 2Ф > М. В этом случае в воде присутствуют карбонаты и гидраты,
Щкарб = 2(М–Ф), Щгидр = (2Ф–М);
5) фенолфталеин дает розовое окрашивание, причем Ф = М (после обесцвечивания фенолфталеина прибавление метилового оранжевого сразу вызывает оранжевую окраску раствора). В этом случае присутствуют только гидраты, Щгидр = Ф.
4. О п р е д е л е н и е п е р м а н г а н а т н о й о к и с л я е м о с т и
Окисляемость - это величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых (при определенных условиях) одним из сильных химических окислителей. Этот показатель отражает общую концентрацию органики в воде. Природа органических веществ может быть самой разной - и гуминовые кислоты почв, и сложная органика растений, и химические соединения антропогенного происхождения.
Различают несколько видов окисляемости воды: перманганатную, бихроматную, иодатную. Наиболее высокая степень окисления достигается бихроматным методом. В практике водоочистки для природных малозагрязненных вод определяют перманганатную окисляемость, а в более загрязненных водах - как правило, бихроматную окисляемость (ХПК - "химическое потребление кислорода").
Величина окисляемости природных вод может варьироваться в широких пределах от долей миллиграммов до десятков миллиграммов О2 на кг воды. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными. Вода равнинных рек как правило имеет окисляемость 5-12 мг О2 /дм3, рек с болотным питанием - десятки миллиграммов на 1 дм3. Подземные воды имеют в среднем окисляемость на уровне от сотых до десятых долей миллиграмма О2 /дм3. ПДК питьевой воды по перманганатной окисляемости согласно СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников» составляет 5,0-7,0 мг/дм3.
Перманганатная окисляемость является условной характеристикой степени загрязненности воды органическими веществами. Перманганатная окисляемость выражается в миллиграммах кислорода, пошедшего на окисление всех окисляемых веществ, содержащихся в 1 дм3 воды.
В ряде случаев при ориентировочной оценке достаточно приблизительного определения окисляемости воды. Для этого используют перманганат калия. Окисление ведут в кислой среде, так как в ней перманганат калия отщепляет больше кислорода.
Ход анализа. В пробирку наливают 10 мл исследуемой воды и прибавляют 0,5 мл серной кислоты в разведении 1:3 и 1 мл 0,01 н. раствора перманганата калия. Смесь хорошо перемешивают и оставляют в покое на 20 минут при температуре выше 20° или на 40 минут при температуре от 10 до 20°. После этого окраску раствора в пробирке при рассмотрении сбоку сравнивают с таблицей приблизительной окисляемости воды
Таблица Приблизительная окисляемость воды
| № п/п | Окраска раствора | Окисляемость воды, мг O2 / дм3 |
| 1. | Яркий лилово-розовый | |
| 2. | Лилово-розовый | |
| 3. | Слабый лилово-розовый | |
| 4. | Бледно-лилово-розовый | |
| 5. | Бледно-розовый | |
| 6. | Розово-желтый | |
| 7. | Желтый | 16 и выше |
Определение перманганатной окисляемости лабораторным путем. Метод основан на окислении веществ, присутствующих в пробе воды, известным количеством перманганата калия в сернокислой среде при кипячении в течение 10 минут. Не вошедший в реакцию перманганат калия восстанавливают щавелевой кислотой. Избыток щавелевой кислоты оттитровывают раствором перманганата калия.
 В коническую колбу вместимостью 250 мл отмеривают 50 мл исследуемой воды, прибавляют 50 мл дистиллированной воды (объем пробы уточняет преподаватель), затем вводят 10 мл 10н серной кислоты и прибавляют из бюретки точно 10 мл 0,01н раствора перманганата. Раствор в колбе из термостойкого стекла нагревают на электрической плитке до кипения и кипятят в течение 10 мин. При этом происходит окисление содержащихся в воде органических примесей за счет восстановления перманганата (окрашенный ион MnO4– переходит в бесцветный ион марганца Mn2+).
В коническую колбу вместимостью 250 мл отмеривают 50 мл исследуемой воды, прибавляют 50 мл дистиллированной воды (объем пробы уточняет преподаватель), затем вводят 10 мл 10н серной кислоты и прибавляют из бюретки точно 10 мл 0,01н раствора перманганата. Раствор в колбе из термостойкого стекла нагревают на электрической плитке до кипения и кипятят в течение 10 мин. При этом происходит окисление содержащихся в воде органических примесей за счет восстановления перманганата (окрашенный ион MnO4– переходит в бесцветный ион марганца Mn2+).
При проведении анализа окисляемости необходимо определить избыток перманганата в растворе, который не был израсходован на окисление органических примесей. К горячему раствору из бюретки прибавляют точно 10 мл 0,01н раствора щавелевой кислоты. При этом должно произойти полное обесцвечивание раствора (щавелевая кислота является сильным восстановителем).
Совершенно бесцветную жидкость при помешивании титруют 0,01н раствором перманганата калия до появления слабо-розовой окраски, не исчезающей в течение минуты. Последнее свидетельствует об окончании титрования, то есть о наличии незначительного избытка перманганата. Если при кипячении в течение 10 мин жидкость обесцветится, побуреет или в ней возникнет коричневый осадок, то определение следует повторить, взяв меньший объем анализируемой воды.
Параллельно проводят контрольное определение окисляемости 100 мл дистиллированной воды.
Величину перманганатной окисляемости вычисляют по формуле
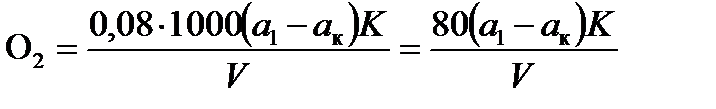 ,
,
где О2 – перманганатная окисляемость, мг О2/ дм3;
а 1, а к – расходы 0,01н раствора KMnO4 на титрование анализируемой и контрольной проб, мл;
К – коэффициент сантинормальности раствора перманганата калия, К = 1 для точно 0,01н раствора;
V – объем анализируемой пробы, взятой для определения, мл;
0,08 – титр точно 0,01н раствора перманганата по кислороду, в случае определения окисляемости по перманганату в приведенной формуле множитель 0,08 заменяют на 0,326 (размерность окисляемости в этом случае – мг KMnO4/кг).
Приложение 2.
Date: 2015-07-24; view: 1870; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |