Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Дослiд 12.1. Розчиннiсть кислот у водi
| Реактиви та матеріали: | кислоти (оцтова, масляна, iзомасляна, акрилова, стеаринова, олеїнова, щавлева, малонова) |
| Обладнання: | пробiрки, скляна паличка, пiпетка, пальник |
3 краплi або декiлька кристалiв кожної з кислот змiшують у пробiрцi з 5 крап-лями води. Якщо кислота не розчиняється, пробiрку нагрiвають. Гарячi розчини охо-лоджують i спостерiгають видiлення кристалiв кислот, якi розчиняються тiльки при нагрiваннi. Для усiх паралельних проб беруть однакову кiлькість кислоти i розчинника.
Кислотнi властивостi карбонових кислот
Дослiд 12.2. Дiя оцтової кислоти на iндикатори
| Реактиви та матеріали: | оцтова кислота (0,1Н розчин); метилоранж; лакмус; 1%-ний спиртовий розчин фенолфталеїну |
| Обладнання: | пробiрки, скляна паличка, пiпетка, пальник |
У три пробiрки наливають по 3 краплi розчину оцтової кислоти. В першу додають краплю метилоранжу, в другу - лакмусу, в третю - фенолфталеїну. В пробiрцi з метиловим оранжевим з'являється червоне забарвлення, в пробiрцi з лакмусом - рожеве, з фенолфталеїном - лишається безбарвним.
Дослiд 12.3. Взаємодiя з металами
| Реактиви та матеріали: | оцтова кислота (0,1Н розчин), магнiй (порошок або ошурки), цинк (шматочки), мiдний дрiт |
| Обладнання: | пробiрки, лучина |
У три пробiрки наливають по 5 крапель розчину оцтової кислоти. В одну додають ошурки магнiю, в другу - шматочки цинку, в третю - мiдний дрiт. В першiй спостерiгаємо енергiйну реакцiю:
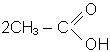 + Mg
+ Mg 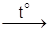 (СН3СОО)2Mg + H2
(СН3СОО)2Mg + H2
ацетат магнію
На пiдтвердження того, що газ, який видiляється, - водень, у пробiрку вносять лучину. При цьому спостерiгається спалах з рiзким звуком, характерним для спалаху сумiшi водню з повiтрям.
У другiй пробiрцi реакцiя йде повiльно i потребує нагрiвання:
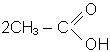 + Zn
+ Zn 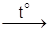 (СН3СОО)2Zn + H2
(СН3СОО)2Zn + H2
ацетат цинку
У третiй пробiрцi реакцiї зовсiм немає.
Дослiд 12.4. Взаємодiя з солями
| Реактиви та матеріали: | оцтова кислота (0,1Н розчин), карбонат натрiю (сухий), баритова вода |
| Обладнання: | пробiрки, газовiдвiдна трубка, лучина |
У пробiрку наливають 2-3 краплi розчину оцтової кислоти i додають кiлька крупинок карбонату натрiю. Пробiрку закривають пробкою з газовiдвiдною трубкою, до отвору якої пiдносять запалену лучину. Лучина гасне. Потiм газовiдвiдну трубку занурюють у пробiрку з баритовою водою, вода каламутнiє вiд вуглекислого газу.
Хiмiзм процесу:
2CH3COOH + Na2CO3 ® 2CH3COONa + CO2 + H2O
ацетат натрiю
Карбоновi кислоти у водному розчинi дисоцiюють з утворенням карбоксилат-анiона i протона:

карбонова кислота
Протон Н+ в карбоксильнiй групi вiдщеплюється легше, нiж у спиртах (вплив полярної карбонiльної групи). Утворення карбоксилат-анiона є причиною збiльшення кислотностi карбонових кислот порiвняно зi спиртами. На легкiсть вiдщеплення протона впливає також радикал, пов'язаний з карбоксильною групою. Тому карбоновi кислоти дають характерне забарвлення з iндикаторами, проводять електричний струм, тобто є електролiтами. Карбоновi кислоти порiвняно з неорганiчними - слабкi кислоти (Кдис.~ 10-5).
Дослід 12.5. Отримання мурашиної кислоти з хлороформу та її відкриття
| Реактиви і матеріали: | 0,2Н AgNO3, 2Н NaOH, 2Н NH4OH, хлороформ. | ||
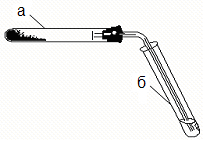
Обладнання: | дві пробірки, пробка з газовідвідною трубкою. У пробірці а (рис. 12.1) приготуйте аміачний розчин гідроксиду срібла - реактив для відкриття альдегідної групи. Для цього візьміть 1 краплю 0,2Н AgNO3 та 1 краплю 2Н NaOH. Утворився осад оксиду срібла. Цей осад розчиніть, додавши 2 краплі 2Н NH4OH та 2 краплі води. У пробірку б помістіть 1 краплю хлороформу та 3 краплі NaOH. Нагрівайте обережно на полум’ї пальника, доки не зникне крапля хлороформу. |
Для відкриття утвореного форміату, який утворився, влийте в пробірку б реактив, заготовлений в пробірці 1. Срібло негайно відновлюється у вигляді чорного осаду:

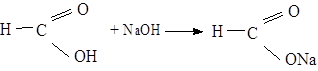
Мурашина кислота може розглядатися як кислота, яка містить альдегідну групу:
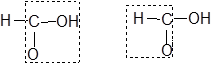
і тому повинна виявляти відновлювальні властивості. У даному випадку для її відкриття можна скористатися реакцією „срібного дзеркала”
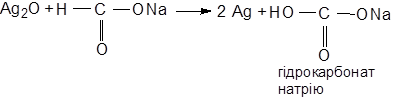
Розклад трьохгалогенопохідних метану при кип¢ятінні з лугом та утворення мурашинокислого натрію пояснює, чому при отриманні хлороформу з хлоральгідрату або йодоформу з етилового спирту не можна кип’ятити розчин.
Цей же дослід показує, що при консервуванні сечі хлороформом клінічна проба Тромера на глюкозу буде позитивною й при відсутності глюкози у сечі.
Дослід 12.6. Отримання натрієвої солі щавлевої кислоти
| Реактиви і матеріали: | мурашинокислий натрій кристалічний, хлорид кальцію, 0,1Н розчин. |
У суху пробірку вміщують декілька крапель мурашинокислого натрію та сильно нагрівають на полум’ї пальника. Розплавлена сіль розкладається з виділенням гідрогену. Вмісту пробірки дають охолонути, додають до плаву 3-4 краплі води та трохи нагрівають до появи прозорого розчину.
В іншу пробірку вміщують декілька кристаликів мурашинокислого натрію та додають 3-4 краплі води. В обидві пробірки додають по 1 краплі розчину хлориду кальцію. У першій пробірці (з щавлевокислим натрієм) виникає білий осад нерозчинної у воді кальцевої солі щавлевої кислоти. У пробірці з розчином мурашинокислого натрію осад не утворюється, бо кальцева сіль мурашиної кислоти розчинна у воді.
Хімізм процесу:
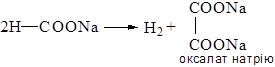


Утворення щавлевої кислоти швидким нагріванням форміату до 420°С є сучасним промисловим способом її отримання.
Дослід 12.7. Відкриття щавлевої кислоти у вигляді кальцевої солі
| Реактиви і матеріали: | оксалат натрію, 0,5Н CaCl2, 2Н CH3COOH, 2Н HCl. |
| Обладнання: | піпетка, предметне скло. |
Отриманий плав оксалату натрію розчиніть у 4-5 краплях води. Якщо необхідно, то підігрійте. При наявності обвуглених частинок дайте їм спочатку осісти на дно. За допомогою піпетки візьміть 1 краплю розчину та нанесіть її на предметне скло. Додайте 1 краплю 0,5Н CaCl2. Що ви спостерігаєте?

|
| Рис. 12.2. Кристали оксалату кальцію з сечового осаду |
Додайте до осаду 1 краплю 2Н CH3COOH - осад не розчиняється. Від додавання 1-2 крапель 2Н HCl осад повністю розчиняється. Зверніть увагу на цю характерну здатність оксалату кальцію. Хід реакції утворення оксалату кальцію:
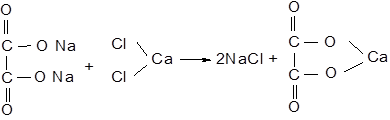
Кристали оксалату кальцію нерідко спостерігаються при клінічному дослідженні сечі і при мікроскопічному дослідженні нагадують поштові конверти (рис. 12.2).
Date: 2015-07-02; view: 859; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |