
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

II. Общая фармакология
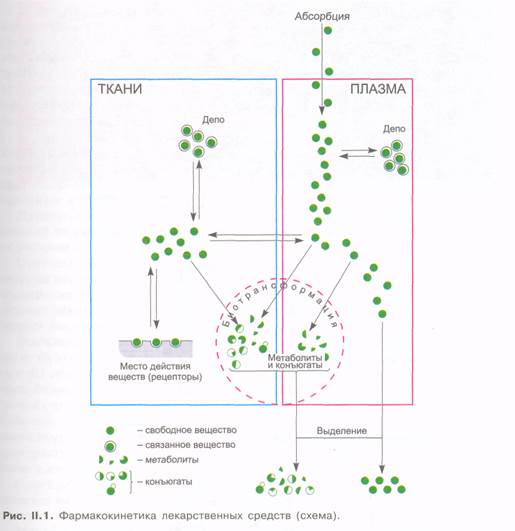
В общей фармакологии приводятся общие закономерности фармакокинетики и фармакодинамики лекарственных средств. Фармакокинетика — это раздел фармакологии о всасывании, распределении в организме, депонировании, метаболизме и выведении веществ (рис. II. 1). Основное содержание фармакодинамики — это биологические эффекты веществ, а также локализация и механизм их действия.
Эффекты лекарственных средств являются результатом их взаимодействия с организмом. В связи с этим специально рассматриваются не только основные свойства веществ, определяющие их физиологическую активность, но также зависимость эффекта от условий и применения данных веществ и состояния организма, на который направлено их действие.
Кроме того, обсуждаются наиболее важные виды фармакотерапии, а также общие закономерности побочного и токсического влияния лекарственных средств.
1. ПУТИ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ. ВСАСЫВАНИЕ
Применение лекарственных средств с лечебными или профилактическими целями начинается с их введения в организм или нанесения на поверхность тела. От пути введения зависят скорость развития эффекта, его выраженность и продолжительность. В отдельных случаях путь введения определяет характер действия веществ.
Существующие пути введения обычно подразделяют на энтеральные (через пищеварительный тракт) и парентеральные (минуя пищеварительный тракт).
К энтеральным путям относится введение через рот, под язык, трансбуккально, в двенадцатиперстную кишку, в прямую кишку (ректально).
Самый распространенный путь введения — через рот (внутрь; per os). Это наиболее удобный и простой путь
введения. Стерильности препаратов в этом случае не требуется. Всасывание (абсорбция) ряда веществ (например, кислоты ацетилсалициловой, барбитуратов и других слабых электролитов, имеющих кислый характер) происходит частично из желудка (рис. II.2). Однако преобладающее большинство лекарственных средств всасывается главным образом в тонкой кишке. Этому благоприятствуют значительная всасывающая поверхность слизистой оболочки кишечника (примерно 200 м2) и ее интенсивное кровоснабжение.
Известны следующие основные механизмы всасывания (рис. П.3).
1. Пассивная диффузия через мембрану клеток. Определяется градиентом концентрации веществ. Таким путем легко всасываются липофильные (главным образом неполярные) вещества. Чем выше липофильность веществ, тем легче они проникают через клеточную мембрану.
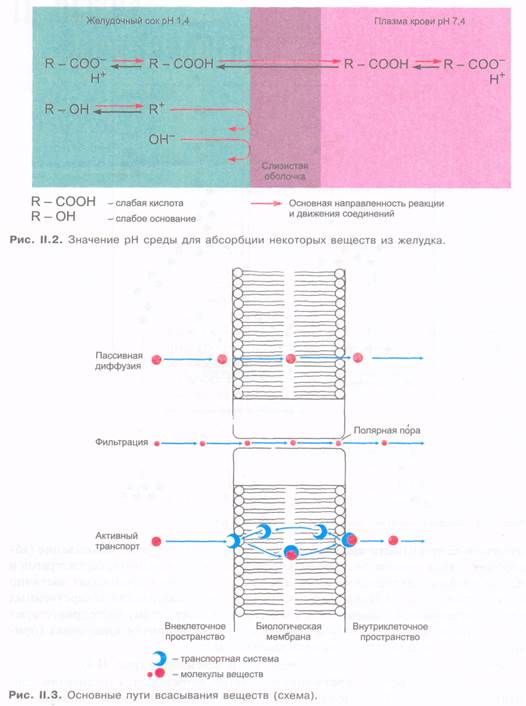
2. Фильтрация через поры мембран. Диаметр пор в мембране эпителия кишечника нев
елик (примерно 0,4 нм, или 4 А). Поэтому через них диффундируют вода, некоторые ионы, а также мелкие гидрофильные молекулы (например, мочевина).
3. Активный транспорт (в этом процессе участвуют транспортные системы клеточных мембран) характеризуется избирательностью к определенным соединениям, возможностью конкуренции двух веществ за один транспортный механизм, насыщаемостью (при высоких концентрациях вещества), возможностью транспорта против градиента концентрации и затратой энергии (метаболические яды угнетают активный транспорт). Активный транспорт обеспечивает всасывание гидрофильных полярных молекул, ряда неорганических ионов, Сахаров, аминокислот, пиримидинов.
4. При пиноцитозе происходит инвагинация клеточной мембраны с последующим образованием пузырька (вакуоли). Последний заполнен жидкостью с захваченными крупными молекулами веществ. Пузырек мигрирует по цитоплазме к
противоположной стороне клетки, где путем экзоцитоза содержимое пузырька выводится наружу.
Приведенные механизмы прохождения веществ через мембрану носят универсальный характер и имеют значение не только для всасывания веществ, но и для их распределения в организме и выделения.
Основным механизмом всасывания лекарственных средств в тонкой кишке является пассивная диффузия. Незначительную роль играет активный транспорт. Фильтрация через поры клеточных мембран практически не имеет значения. Всасывание некоторых белков и комплекса цианокобаламина (витамин В12) с внутренним фактором Касла осуществляется, по-видимому, путем пиноцитоза.
Всасывание из тонкой кишки происходит относительно медленно. Оно зависит от функционального состояния слизистой оболочки кишечника, его моторики и рН среды, количества и качественной характеристики содержимого кишечника. Важно иметь в виду, что из тонкой кишки вещества попадают в печень (где часть их инактивируется или экскретируется с желчью) и лишь затем — в общий кровоток. Следует учитывать, что некоторые вещества неэффективны при назначении внутрь, так как разрушаются под влиянием ферментов желудочно-кишечного тракта (например, инсулин), а также при определенной реакции среды, особенно в кислой среде желудка (например, бензилпенициллин).
Если препарат разрушается желудочным соком или оказывает раздражающее действие на слизистую оболочку желудка, его назначают в специальных лекарственных формах (капсулах, драже), которые растворяются только в тонкой кишке.
Абсорбция веществ регулируется также специальным мембранным транспортером — Р-гликопротеином. Он способствует выведению веществ в просвет кишечника и препятствует их абсорбции.
Р-гликопротеиновый насос имеется также в гематоэнцефалическом барьере, почках, печени, плаценте и других тканях. Таким образом, эта транспортная система влияет на многие процессы: абсорбцию, распределение, элиминацию.
Известны ингибиторы Р-гликопротеина — циклоспорин А, хинидин, верапамил, итраконазол и многие другие. Имеются данные, что рифампин является индуктором этого транспортера.
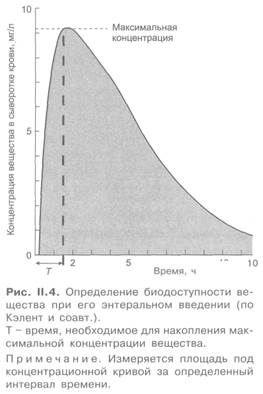 В связи с тем что системное действие вещества развивается только после его попадания в кровоток, откуда оно поступает в ткани, предложен термин «биодоступность». Он отражает количество неизмененного вещества, которое достигло плазмы крови, относительно исходной дозы препарата. В данном случае при энтеральном введении величина биодоступности определяется потерями вещества при его всасывании из пищеварительного тракта и при первом прохождении через печеночный барьер. Для суждения о биодоступности обычно измеряют площадь под кривой, отражающей зависимость между концентрацией вещества в плазме крови и временем (рис. П.4), поскольку этот показатель прямо пропорционален количеству вещества, попавшему в системный кровоток. Определяют также максимальную концентрацию свободного (активного) вещества в плазме крови и время, необходимое для ее достижения. Биодоступность вещества при внутривенном введении принимают за 100%. О биодоступности можно судить и по выделению препарата с мочой при условии, если он не подвергается биотрансформации. В отдельных случаях критерием биодоступности может служить величина фармакологического эффекта, если возможно его точное количественное измерение.
В связи с тем что системное действие вещества развивается только после его попадания в кровоток, откуда оно поступает в ткани, предложен термин «биодоступность». Он отражает количество неизмененного вещества, которое достигло плазмы крови, относительно исходной дозы препарата. В данном случае при энтеральном введении величина биодоступности определяется потерями вещества при его всасывании из пищеварительного тракта и при первом прохождении через печеночный барьер. Для суждения о биодоступности обычно измеряют площадь под кривой, отражающей зависимость между концентрацией вещества в плазме крови и временем (рис. П.4), поскольку этот показатель прямо пропорционален количеству вещества, попавшему в системный кровоток. Определяют также максимальную концентрацию свободного (активного) вещества в плазме крови и время, необходимое для ее достижения. Биодоступность вещества при внутривенном введении принимают за 100%. О биодоступности можно судить и по выделению препарата с мочой при условии, если он не подвергается биотрансформации. В отдельных случаях критерием биодоступности может служить величина фармакологического эффекта, если возможно его точное количественное измерение.
При введении вещества под язык — сублингвально (в таблетках, гранулах, каплях) — всасывание начинается довольно быстро. В этом случае препараты оказывают общее действие, минуя при первом пассаже печеночный барьер и не контактируя с ферментами и средой желудочно-кишечного тракта. Сублингвально назначают некоторые вещества с высокой активностью (отдельные гормональные средства, нитроглицерин), доза которых невелика.
Иногда препараты вводят через зонд в двенадцатиперстную кишку (например, магния сульфат в качестве желчегонного), что позволяет быстро создать в кишечнике высокую концентрацию соединения.
При введении в прямую кишку (per rectum) значительная часть вещества (около 50%) поступает в кровоток, минуя печень. Кроме того, при таком пути введения вещество не подвергается воздействию ферментов пищеварительного тракта. Всасывание из прямой кишки происходит путем простой диффузии. Ректально лекарственные средства назначают в суппозиториях или в лекарственных клизмах (объем 50 мл). Если вещества оказывают раздражающее влияние, их комбинируют со слизями.
Лекарственные вещества, имеющие структуру белков, жиров и полисахаридов, в толстой кишке не всасываются.
Ректально применяют вещества и для местного воздействия.
К парентеральным путям введения относят подкожный, внутримышечный, внутривенный, внутриартериальный, интрастернальный, внутрибрюшинный, ингаляционный, субарахноидальный, субокципитальный и некоторые другие.
Из парентеральных путей наиболее распространенным является введение веществ под кожу, в мышцу и в вену. Особенно быстро наступает эффект при внутривенном введении, несколько медленнее — при внутримышечном и подкожном введении. Для пролонгирования фармакотерапевтического эффекта лекарственные вещества вводят в мышцу в малорастворимом виде (взвесь) в масле или других основах, задерживающих всасывание веществ из места введения.
Внутримышечно и подкожно не следует вводить вещества, оказывающие выраженное раздражающее действие, так как это может быть причиной воспалительных реакций, инфильтратов и даже некроза.
Внутривенно лекарственные средства вводят обычно медленно. Возможны однократное, дробное, капельное введение и инфузия. Внутривенно нельзя вводить нерастворимые соединения, масляные растворы (возможность эмболии), средства с выраженным раздражающим действием (могут привести к развитию тромбоза, тромбофлебита), препараты, вызывающие свертываемость крови или гемолиз.
Отрицательными чертами указанных 3 путей введения являются их относительная сложность, а также болезненность, необходимость стерильности препаратов, участия медицинского персонала.
Внутриартериальное введение позволяет создать в области, которая кровоснабжается данной артерией, высокие концентрации вещества. Таким путем иногда вводят противоопухолевые средства. Для уменьшения их общего токсического действия отток крови может быть искусственно затруднен (путем пережатия вен). Внутриартериально вводят также рентгеноконтрастные препараты, что позволяет точно определить локализацию опухоли, тромба, сужения сосудов, аневризмы.
Интрастернальный путь введения (в грудину) обычно используют при технической невозможности внутривенного введения (у детей, людей старческого возраста).
Внутрибрюшинно препараты вводят редко (например, антибиотики во время брюшнополостных операций).
Иногда лекарственные средства назначают интраплеврально (в плевральную полость).
Для газообразных и летучих соединений основным является ингаляционный путь введения. Таким же путем вводят и некоторые аэрозоли. Легкие — это обширная абсорбционная зона (90—100 м2), получающая обильное кровоснабжение, поэтому всасывание веществ при их ингаляции происходит быстро. Выраженностью эффекта легко управлять, изменяя концентрацию вещества во вдыхаемом воздухе. Скорость всасывания зависит также от объема дыхания, активной поверхности альвеол и их проницаемости, растворимости веществ в крови и скорости тока крови.
Лекарственные средства, плохо проникающие через гематоэнцефалический барьер, могут быть введены под оболочки мозга (субарахноидально, субдурально или субокципитально). Например, так применяют некоторые антибиотики при инфекционном поражении тканей и оболочек мозга. Субарахноидально вводят местные анестетики с целью спинномозговой анестезии.
Некоторые препараты (обычно высоколипофильные) всасываются и оказывают резорбтивное действие при нанесении их на кожу (например, нитроглицерин). Трансдермальные лекарственные формы получают все большее распространение, так как с их помощью удается длительно поддерживать стационарную концентрацию веществ в плазме крови.
Иногда пользуются ионофоретическим введением ионизированных веществ (с кожи или со слизистых оболочек). Их всасывание обеспечивается слабым электрическим полем.
Отдельные препараты назначают интраназально (в частности, адиурекрин). Всасывание в данном случае происходит со слизистой оболочки полости носа.
2. РАСПРЕДЕЛЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ В ОРГАНИЗМЕ. БИОЛОГИЧЕСКИЕ БАРЬЕРЫ. ДЕПОНИРОВАНИЕ
После абсорбции вещества попадают в кровь, а затем в разные органы и ткани. Большинство лекарственных средств распределяется неравномерно и лишь незначительная часть — относительно равномерно (например, некоторые ингаляционные средства для наркоза). Существенное влияние на характер распределения веществ оказывают биологические барьеры, которые встречаются на пути их распространения: стенка капилляров, клеточные (плазматические) мембраны, гематоэнцефалический и плацентарный барьеры.
Через стенку капилляров, имеющую характер пористой мембраны (величина пор у человека в среднем составляет 2 нм), большинство лекарственных средств проходит довольно легко. Исключение составляют белки плазмы и их комплексы с препаратами. Гидрофильные соединения, хорошо растворимые в воде, проходят через поры стенки капилляров и попадают в интерстициальное пространство. Через белково-фосфолипидные мембраны клеток они практически не диффундируют (внутрь клеток могут попадать лишь при участии транспортных систем). Липофильные соединения хорошо проникают через эндотелий капилляров и клеточные мембраны (рис. II.5).
Затруднено прохождение многих веществ через гематоэнцефалический барьер. Это связано с особенностями строения капилляров мозга (рис. П.6). Прежде всего их эндотелий не имеет пор, через которые в обычных капиллярах проходят многие вещества. В капиллярах мозга практически отсутствует пиноцитоз. Определенное значение имеют и глиальные элементы (астроглия), выстилающие наружную поверхность эндотелия и, очевидно, играющие роль дополнительной липидной мембраны. Через гематоэнцефалический барьер плохо проходят полярные соединения. Липофильные молекулы проникают в ткани мозга легко. В основном вещества проходят через гематоэнцефалический барьер путем диффузи 
а некоторые соединения — за счет активного транспорта. Имеются отдельные небольшие участки головного мозга (область эпифиза, задней доли гипофиза и др.), в которых гематоэнцефалический барьер практически неэффективен. Следует также иметь в виду, что при некоторых патологических состояниях (например, при воспалении мозговых оболочек) проницаемость гематоэнцефалического барьера повышается.
Прохождение веществ через гематоэнцефалический барьер регулируется также Р-гликопротеиновым насосом. Он способствует выведению веществ из мозговой ткани в кровь (efflux transporter), а также препятствует проникновению ряда соединений из крови в ЦНС.
Сложным биологическим барьером является плацентарный барьер. Через него проходят липофильные соединения (путем диффузии). Ионизированные полярные вещества (например, четвертичные аммониевые соли) через плаценту проникают плохо. В плаценте также имеется Р-гликопротеиновый насос.
В некоторой степени распределение зависит от сродства препаратов к тем или иным тканям. Определенное значение имеет также интенсивность кровоснабжения органа или ткани. Следует учитывать, что значительные количества вещества могут накапливаться на путях их выведения. Лекарственные средства, циркулирующие в организме, частично связываются, образуя внеклеточные и клеточные депо.
К экстрацеллюлярным депо могут быть отнесены белки плазмы (особенно альбумины). Некоторые вещества связываются с ними весьма интенсивно. Например, неопиоидный анальгетик бутадиен связывается с белками плазмы более чем на 90%.
Вещества могут накапливаться в соединительной ткани (некоторые полярные соединения, в том числе четвертичные аммониевые соли), в костной ткани (тетрациклины).
Некоторые препараты (в частности, акрихин) в особенно больших количествах обнаруживаются в клеточных депо. Связывание их в клетках возможно за счет белков, нуклеопротеидов и фосфолипидов.
Жировые депо представляют особый интерес, так как в них могут задерживаться липофильные соединения (в частности, некоторые средства для наркоза).
Депонируются лекарственные средства, как правило, за счет обратимых связей. Продолжительность их нахождения в тканевых депо варьирует в широких пределах. Так, некоторые сульфаниламиды (сульфадиметоксин и др.) образуют стойкие комплексы с белками плазмы, с чем частично связана значительная продолжительность их действия. Очень длительно задерживаются в организме ионы тяжелых металлов.
Следует учитывать, что распределение веществ, как правило, не характеризует направленность их действия. Последняя зависит от чувствительности к ним тканей, т.е. от сродства лекарственных средств к тем биологическим субстратам, которые определяют специфичность их действия.
В клинической фармакологии нередко используют параметр кажущийся объем распределения — Vd. Он отражает предположительный объем жидкости, в котором распределяется вещество (условно принимается, что концентрация вещества в плазме и других жидких средах организма одинакова).

Объем распределения дает представление о фракции вещества, находящейся в плазме крови. Для липофильных соединений, легко проникающих через тканевые барьеры и имеющих широкое распределение (в плазме, интерстициальной жидкости, во внутриклеточной жидкости), характерно высокое значение Vd. Если вещество в основном циркулирует в крови, Vd имеет низкие величины. Данный параметр важен для рационального дозирования веществ, а также для определения константы скорости элиминации (Kelim) и «периода полужизни» вещества (t1/2).
3. ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ (БИОТРАНСФОРМАЦИЯ, МЕТАБОЛИЗМ) ЛЕКАРСТВЕННЫХ СРЕДСТВ В ОРГАНИЗМЕ
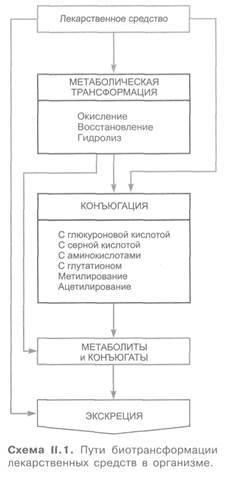 Большинство лекарственных средств подвергается в организме биотрансформации (схема II.1). В неизмененном виде выделяются главным образом высокогидрофильные ионизированные соединения. Из липофильных веществ исключение составляют средства для ингаляционного наркоза, основная часть которых в химические реакции в организме не вступает. Они выводятся легкими в том же виде, в каком были введены. В биотрансформации лекарственных средств принимают участие многие ферменты, из которых важнейшая роль принадлежит икросомальным ферментам печени (находятся в эндоплазматической сети). Они метаболизируют чужеродные для организма липофильные соединения (разной структуры), превращая их в более гидрофильные. Субстратной специфичности у них нет. Существенное значение имеют и немикросомальные ферменты разной локализации (печени, кишечника и других тканей, а также плазмы), особенно в случае биотрансформации гидрофильных веществ.
Большинство лекарственных средств подвергается в организме биотрансформации (схема II.1). В неизмененном виде выделяются главным образом высокогидрофильные ионизированные соединения. Из липофильных веществ исключение составляют средства для ингаляционного наркоза, основная часть которых в химические реакции в организме не вступает. Они выводятся легкими в том же виде, в каком были введены. В биотрансформации лекарственных средств принимают участие многие ферменты, из которых важнейшая роль принадлежит икросомальным ферментам печени (находятся в эндоплазматической сети). Они метаболизируют чужеродные для организма липофильные соединения (разной структуры), превращая их в более гидрофильные. Субстратной специфичности у них нет. Существенное значение имеют и немикросомальные ферменты разной локализации (печени, кишечника и других тканей, а также плазмы), особенно в случае биотрансформации гидрофильных веществ.
Выделяют 2 основных вида превращения лекарственных препаратов: 1) метаболическую трансформацию и 2) конъюгацию.
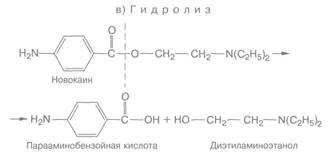
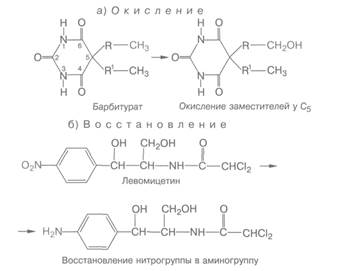 Метаболическая трансформация — это превращение веществ за счет окисления, восстановления и гидролиза. Так, окислению подвергаются имизин, эфедрин, аминазин, гистамин, кодеин. Окисление происходит преимущественно за счет микросомальных оксидаз смешанного действия при участии НАДФ, кислорода и цитохрома Р-450. Восстановлению подвергаются отдельные лекарственные вещества (хлоралгидрат, левомицетин, нитразепам и др.). Происходит это под влиянием системы нитро- и азоредуктаз и других ферментов. Сложные эфиры (новокаин, атропин, ацетилхолин, дитилин, кислота ацетилсалициловая) и амиды (новокаинамид) гидролизуются при участии эстераз, карбоксилэстераз, амидаз, фосфатаз и др. Для иллюстрации можно воспользоваться следующими примерами:
Метаболическая трансформация — это превращение веществ за счет окисления, восстановления и гидролиза. Так, окислению подвергаются имизин, эфедрин, аминазин, гистамин, кодеин. Окисление происходит преимущественно за счет микросомальных оксидаз смешанного действия при участии НАДФ, кислорода и цитохрома Р-450. Восстановлению подвергаются отдельные лекарственные вещества (хлоралгидрат, левомицетин, нитразепам и др.). Происходит это под влиянием системы нитро- и азоредуктаз и других ферментов. Сложные эфиры (новокаин, атропин, ацетилхолин, дитилин, кислота ацетилсалициловая) и амиды (новокаинамид) гидролизуются при участии эстераз, карбоксилэстераз, амидаз, фосфатаз и др. Для иллюстрации можно воспользоваться следующими примерами:
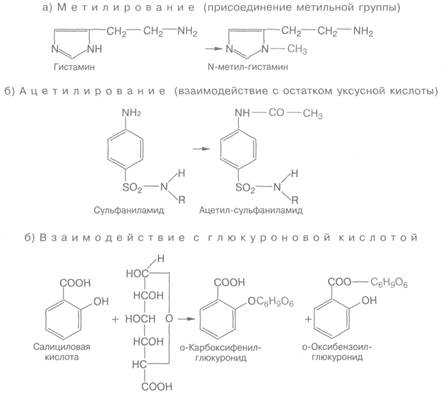
Конъюгация — это биосинтетический процесс, сопровождающийся присоединением к лекарственному веществу или его метаболитам ряда химических группировок или молекул эндогенных соединений. Так, например, могут происходить метилирование веществ (гистамин, катехоламины) или их ацетилирование (сульфаниламиды), взаимодействие с глкжуроновой кислотой (морфин, оксазепам), сульфатами (левомицетин, фенол), глутатионом (парацетамол) и т.д.
В процессах конъюгации участвуют многие ферменты: глюкуронилтрансфераза, сульфотрансфераза, трансацилаза, метилтрансферазы, глутатионил-S-трансферазы и др.
Примеры образования конъюгатов:
Конъюгация может быть единственным путем превращения веществ либо она следует за предшествующей ей метаболической трансформацией (см. схему II. 1).
При метаболической трансформации и конъюгации вещества переходят в более полярные и более водорастворимые метаболиты и конъюгаты. Это благоприятствует их дальнейшим химическим превращениям, если они необходимы, а также способствует их выведению из организма. Известно, что почками выводятся гидрофильные соединения, тогда как липофильные в значительной степени подвергаются в почечных канальцах обратному всасыванию (реабсорбции) (рис. II.7).В результате метаболической трансформации и конъюгации лекарственные средства обычно теряют свою биологическую активность. Таким образом, эти процессы лимитируют во времени действие веществ. При патологии печени, сопровождающейся снижением активности микросомальных ферментов, продолжительность действия ряда веществ увеличивается. Известны и ингибиторы различных ферментов, как микросомальных (левомицетин, бутадиен), так и немикросомальных (антихолинэстеразные средства, ингибиторы МАО и др.). Они пролонгируют эффекты препаратов, которые инактивируются этими ферментами. Вместе с тем есть соединения (например, фенобарбитал), которые повышают (индуцируют) скорость синтеза микросомальных ферментов.
В отдельных случаях химические превращения лекарственных средств в организме могут приводить к повышению активности образующихся соединений (имизин < дезипрамин), повышению токсичности (фенацетин < фенетидин), изменению характера действия (одним из метаболитов антидепрессанта ипразида является изониазид, обладающий противотуберкулезной активностью), а также к превращению одного активного соединения в другое (кодеин частично превращается в морфин).
4. ПУТИ ВЫВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ИЗ ОРГАНИЗМА
Лекарственные средства, их метаболиты и конъюгаты в основном выводятся с мочой и желчью.
В почках низкомолекулярные соединения, растворенные в плазме (не связанные с белками), фильтруются через мембраны капилляров клубочков и капсул (рис. II.8 и II.9). Кроме того, существенную роль играет активная секреция веществ в проксимальных канальцах с участием транспортных систем.
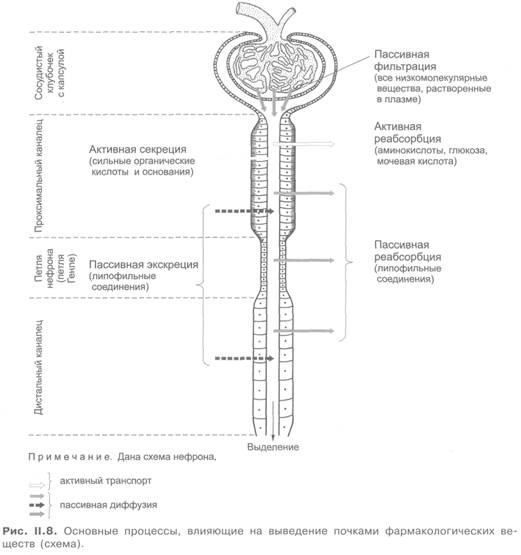
Этим путем выделяются органические кислоты и основания, пенициллины, салицилаты, сульфаниламиды, хинин, гистамин, тиазиды и др. Некоторые липофильные соединения могут проникать из крови в просвет канальцев (проксимальных и дистальных) путем простой диффузии через их стенки.
Выведение веществ в значительной степени зависит от процесса их реабсорбции (обратное всасывание) в почечных канальцах. Лекарственные средства реабсорбируются главным образом путем простой диффузии. Это касается в основном липофильных неполярных соединений, хорошо проникающих через биологические мембраны. Полярные соединения плохо реабсорбируются из почечных канальцев. В связи с этим для выведения слабых кислот и оснований важное значение имеет рН мочи. Так, при щелочной реакции мочи повышается выведение кислых соединений (например, кислоты салициловой, фенобарбитала), а при кислой — повышается выведение оснований (имизина и др.). Обусловлено это тем, что в указанных условиях соединения ионизированы и практически не реабсорбируются из почечных канальцев.
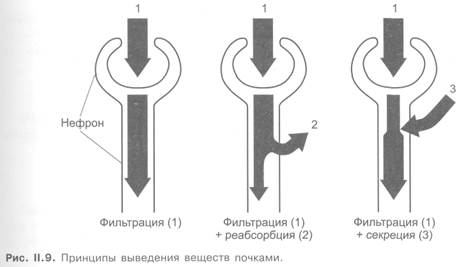
Кроме того, в реабсорбции ряда эндогенных веществ (аминокислоты, глюкоза, мочевая кислота) принимает участие активный транспорт.
Ряд препаратов (тетрациклины, пенициллины, дифенин, колхицин и др.) и особенно продукты их превращения в значительном количестве выделяются с желчью в кишечник, откуда частично выводятся с экскрементами, а также могут повторно всасываться и в последующем вновь выделяться в кишечник и т.д. (так называемая кишечно-печеночная циркуляция, или печеночная рециркуляция; рис. 11.10).
Газообразные и многие летучие вещества (например, средства для ингаляционного наркоза) выводятся в основном легкими.
Отдельные препараты выделяются слюнными железами (йодиды), потовыми (противолепрозное средство дитофал), железами желудка (хинин, никотин) и кишечника (слабые органические кислоты), слезными железами (рифампицин).
Следует также учитывать, что в период лактации молочными железами выделяются многие вещества, которые получает кормящая мать (снотворные, болеутоляющие средства, спирт этиловый, никотин и др.). В связи с этим требуется особая осторожность в назначении матери лекарственных средств, так как с молоком они могут попасть в организм ребенка и оказать на него неблагоприятное влияние.
Элиминация (удаление) вещества из организма обеспечивается экскрецией и биотрансформацией. Для количественной характеристики процесса элиминации используется ряд параметров: константа скорости элиминации (Kelim), «период полужизни» (t1/2) и общий клиренс (СlТ).
Константа скорости элиминации (Kelim) отражает скорость удаления вещества из организма. Определяется по формуле:

Для суждения о скорости выведения веществ из организма используют также параметр «период полужизни» (полуэлиминации) — t1/2, который отражает время, необходимое для снижения концентрации вещества в плазме крови на 50%:
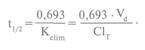
Этот параметр используется для подбора доз веществ и интервалов их введения при создании стационарной концентрации препарата. Известно, что выведение веществ более чем на 90% осуществляется за время, равное 4 t1/2 что и учитывается при их дозировании. Следует иметь в виду, что t1/2 определяется не только выведением вещества из организма, но также его биотрансформацией и депонированием.
Кроме того, для количественной характеристики скорости элиминации веществ используют параметр клиренс (Сl), отражающий скорость очищения плазмы крови от вещества (выражается в объеме в единицу времени, при необходимости с учетом массы тела или его поверхности: мл/мин, мл/кг/мин, л/м2/ч и т.д.). Выделяют общий (тотальный) клиренс (СlТ), а также почечный (ClR) и печеночный (СlH) клиренс.

Общий клиренс связан с такими параметрами, как объем распределения (Vd), «период полужизни» (t1/2) и константа скорости элиминации (Kelim).

Почечный клиренс зависит от процессов фильтрации, секреции и реабсорбции. Судить о почечном клиренсе можно на основании сопоставления концентраций вещества в моче и плазме крови (учитывая также скорость тока мочи).
Печеночный клиренс связан с захватом вещества гепатоцитами и его последующей биотрансформацией, а также с секрецией препарата в желчные пути.
5. МЕСТНОЕ И РЕЗОРБТИВНОЕ ДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ. ПРЯМОЕ И РЕФЛЕКТОРНОЕ ДЕЙСТВИЕ. ЛОКАЛИЗАЦИЯ И МЕХАНИЗМ ДЕЙСТВИЯ. «МИШЕНИ» ДЛЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ. ОБРАТИМОЕ И НЕОБРАТИМОЕ ДЕЙСТВИЕ. ИЗБИРАТЕЛЬНОЕ ДЕЙСТВИЕ
Действие вещества, возникающее в месте его приложения, называют местным. Например, обволакивающие средства покрывают слизистую оболочку, препятствуя раздражению окончаний афферентных нервов. При поверхностной анестезии нанесение местного анестетика на слизистую оболочку ведет к блоку окончаний чувствительных нервов только в месте нанесения препарата. Однако истинно местное действие наблюдается крайне редко, так как вещества могут либо частично всасываться, либо оказывать рефлекторное влияние.
Действие вещества, развивающееся после его всасывания, поступления в общий кровоток и затем в ткани, называют резорбтивным. Резорбтивное действие зависит от путей введения лекарственных средств и их способности проникать через биологические барьеры.
При местном и резорбтивном действии лекарственные средства оказывают либо прямое, либо рефлекторное влияние. Первое реализуется на месте непосредственного контакта вещества с тканью. При рефлекторном воздействии вещества влияют на экстеро- или интероцепторы и эффект проявляется изменением состояния либо соответствующих нервных центров, либо исполнительных органов. Так, использование горчичников при патологии органов дыхания рефлекторно улучшает их трофику (эфирное горчичное масло стимулирует экстероцепторы кожи). Препарат лобелии, вводимый внутривенно, оказывает возбуждающее влияние на хеморецепторы каротидного клубочка и, рефлекторно стимулируя центр дыхания, увеличивает объем и частоту дыхания.
Основная задача фармакодинамики — выяснить, где и каким образом действуют лекарственные средства, вызывая те или иные эффекты. Благодаря усовершенствованию методических приемов эти вопросы решаются не только на системном и органном, но и на клеточном, субклеточном, молекулярном и субмолекулярном уровнях. Так, для нейротропных средств устанавливают те структуры нервной системы, синаптические образования которых обладают наиболее высокой чувствительностью к данным соединениям. Для веществ, влияющих на метаболизм, определяется локализация ферментов в разных тканях, клетках и субклеточных образованиях, активность которых изменяется особенно существенно. Во всех случаях речь идет о тех биологических субстратах-«мишенях», с которыми взаимодействует лекарственное вещество.
В качестве «мишеней» для лекарственных средств служат рецепторы, ионные каналы, ферменты, транспортные системы и гены.
Рецепторами называют активные группировки макромолекул субстратов, с которыми взаимодействует вещество. Рецепторы, обеспечивающие проявление действия веществ, называют специфическими.
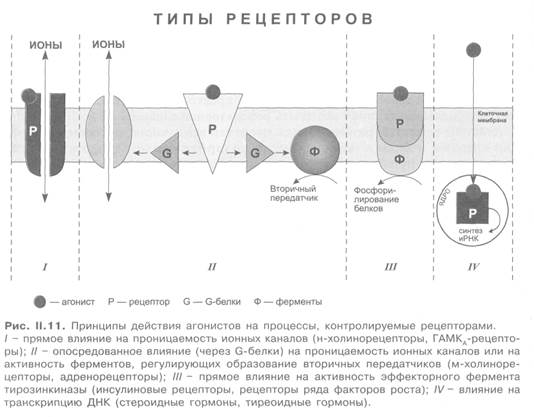
Выделяют следующие 4 типа рецепторов (рис. II.11).
I. Рецепторы, осуществляющие прямой контроль за функцией ионных каналов. К этому типу рецепторов, непосредственно сопряженных с ионными каналами, относятся н-холинорецепторы, ГАМКA-рецепторы, глутаматные рецепторы.
II. Рецепторы, сопряженные с эффектором через систему «G-белки — вторичные передатчики» или «G-белки — ионные каналы». Такие рецепторы имеются для многих гормонов и медиаторов (м-холинорецепторы, адренорецепторы).
III. Рецепторы, осуществляющие прямой контроль функции эффекторного фермента. Они непосредственно связаны с тирозинкиназой и регулируют фосфорилирование белков. По такому принципу устроены рецепторы инсулина, ряда факторов роста.
IV. Рецепторы, контролирующие транскрипцию ДНК. В отличие от мембранных рецепторов I—III типов, это внутриклеточные рецепторы (растворимые цитозольные или ядерные белки). С такими рецепторами взаимодействуют стероидные и тиреоидные гормоны.
Весьма плодотворным оказалось изучение подтипов рецепторов (табл. II.1) и связанных с ними эффектов. К числу первых исследований такого рода относятся работы по синтезу многих β-адреноблокаторов, широко применяемых при различных заболеваниях сердечно-сосудистой системы. Затем появились блокаторы гистаминовых Н2-рецепторов — эффективные средства для лечения язвенной болезни желудка и двенадцатиперстной кишки. В последующем было синтезировано множество других препаратов, действующих на разные подтипы α-адренорецепторов, дофаминовых, опиоидных рецепторов и др. Эти исследования сыграли большую роль в создании новых групп избирательно действующих лекарственных веществ, которые нашли широкое применение в медицинской практике.
Таблица II.1 Примеры некоторых рецепторов и их подтипов
| Рецепторы | Подтипы1 |
| Аденозиновые рецепторы | А1, А2А, А2B, A3 |
| α1-Адренорецепторы | α1A, α1B, α1C |
| α2-Адренорецепторы | α2A, α2B, α2C |
| β-Адренорецепторы | β1, β2, β3 |
| Ангиотензиновые рецепторы | АТ1, АТ2 |
| Брадикининовые рецепторы | B1, B2 |
| ГАМК-рецепторы | GABAA, GABAB, GABAC |
| Гистаминовые рецепторы | H1, H2, H3, H4 |
| Дофаминовые рецепторы | D1, D2, D3, D4, D5 |
| Лейкотриеновые рецепторы | LTB4, LTC4, LTD4 |
| М-холинорецепторы | М1, М2, М3, М4 |
| Н-холинорецепторы | Мышечного типа, нейронального типа |
| Опиоидные рецепторы | µ, δ, κ |
| Простаноидные рецепторы | DP, FP, IP, TP, EP1, EP2, EP3 |
| Пуриновые рецепторы Р | P2X, P2Y, P2Z, P2T, P2U |
| Рецепторы возбуждающих аминокислот (ионотропные) | NMDA, AMPA, каинатные |
| Рецепторы нейропептида Y | Y1, Y2 |
| Рецепторы предсердного натрийуретического пептида | ANPA, ANPB |
| Серотониновые рецепторы | 5-HT1(A-F), 5-HT2(A-C), 5-HT3, 5-HT4, 5-HT5(A-B), 5-HT6, 5-HT7 |
| Холецистокининовые рецепторы | CCKA, CCKB |
Рассматривая действие веществ на постсинаптические рецепторы, следует отметить возможность аллостерического связывания веществ как эндогенного (например, глицин), так и экзогенного (например, анксиолитики бензодиазепинового ряда; см. главу II.4, рис. II.2) происхождения. Аллостерическое взаимодействие с рецептором не вызывает «сигнала». Происходит, однако, модуляция основного медиаторного эффекта, который может как усиливаться, так и ослабляться. Создание веществ такого типа открывает новые возможности регуляции функций ЦНС. Особенностью нейромодуляторов аллостерического действия является то, что они не оказывают прямого действия на основную медиаторную передачу, а лишь видоизменяют ее в желаемом направлении.
Важную роль для понимания механизмов регуляции синаптической передачи сыграло открытие пресинаптических рецепторов (табл. II.2). Были изучены пути гомотропной ауторегуляции (действие выделяющего медиатора на пресинаптические рецепторы того же нервного окончания) и гетеротропной регуляции (пресинаптическая регуляция за счет другого медиатора) высвобождения медиаторов, что позволило по-новому оценить особенности действия многих веществ. Эти сведения послужили также основой для целенаправленного поиска ряда препаратов (например, празозина).
Сродство вещества к рецептору, приводящее к образованию с ним комплекса «вещество—рецептор», обозначается термином «аффинитет». Способность вещества при взаимодействии с рецептором стимулировать его и вызывать тот или иной эффект называется внутренней активностью.
Вещества, которые при взаимодействии со специфическими рецепторами вызывают в них изменения, приводящие к биологическому эффекту, называют агонистами (они и обладают внутренней активностью). Стимулирующее действие агониста на рецепторы может приводить к активации или угнетению функции клетки. Если агонист, взаимодействуя с рецепторами, вызывает максимальный эффект, его называют полным агонистом. В отличие от последнего частичные агонисты при взаимодействии с теми же рецепторами не вызывают максимального эффекта. Вещества, связывающиеся с рецепторами, но не вызывающие их стимуляцию, называют антагонистами. Внутренняя активность у них отсутствует (равна 0). Их фармакологические эффекты обусловлены антагонизмом с эндогенными лигандами (медиаторами, гормонами), а также с экзогенными веществами-агонистами.
| Эффект | Пресинаптические рецепторы |
| Угнетение высвобождения медиатора | М2-холинорецепторы α2-Адренорецепторы Серотониновые 5-HT1-рецепторы Пуриновые Р1-рецепторы Простагландиновые рецепторы Гистаминовые Н2-рецепторы Опиоидные δ-рецепторы Дофаминовые D2-рецепторы |
| Стимуляция высвобождения медиатора | β-Адренорецепторы AT1-рецепторы ангиотензина II |
Таблица II.2 Примеры пресинаптической регуляции высвобождения медиаторов холинергическими и адренергическими окончания
Если они занимают те же рецепторы, с которыми взаимодействуют агонисты, то речь идет о конкурентных антагонистах, если — другие участки макромолекулы, не относящиеся к специфическому рецептору, но взаимосвязанные с ним, то — о неконкурентных антагонистах. При действии вещества как агониста на один подтип рецепторов и как антагониста — на другой, его обозначают агонистом-антагонистом. Например, анальгетик пентазоцин является антагонистом µ- и агонистом δ- и κ-опиоидных рецепторов.
Выделяют и так называемые неспецифические рецепторы, не связанные функционально со специфическими. К ним можно отнести белки плазмы крови, мукополисахариды соединительной ткани и др., с которыми вещества связываются, не вызывая никаких эффектов. Такие рецепторы иногда называют «молчащими» или обозначают как «места потери» веществ. Однако рецепторами целесообразно называть только специфические рецепторы; неспецифические рецепторы правильнее обозначать как места неспецифического связывания.
Взаимодействие «вещество—рецептор» осуществляется за счет межмолекулярных связей. Один из видов наиболее прочной связи — ковалентная. Она известна для небольшого числа препаратов (α-адреноблокатор феноксибензамин, некоторые противобластомные вещества). Менее стойкой является распространенная ионная связь, осуществляемая за счет электростатического взаимодействия веществ с рецепторами. Последняя типична для ганглиоблокаторов, курареподобных средств, ацетилхолина. Важную роль играют ван-дер-ваальсовы силы, составляющие основу гидрофобных взаимодействий, а также водородные связи (табл. II.З).
Таблица II.3 Типы взаимодействия веществ с рецептором
| Типы Взаимодействия | Примерная прочность связи | Уменьшение прочности связи в зависимости от расстояния между атомами (r) | |
| ккал/моль | кДж/моль | ||
| Ковалентные | 50—100 | 210—420 | |
| Электростатические (ионные) | r-2 | ||
| Ион-дипольные | 2—5 | 8—21 | r-3 |
| Димполь-дипольные | 1—3 | 4—12 | r-4 |
| Водородные связи | 2—5 | 8—12 | r-4 |
| Ван-дер-ваальсовы (дисперсионные) | 0,5 | r-7 | |
| Гидрофобные1 | * |
1 Имеется в виду взаимодействие неполярных молекул в водной среде
* 0,7 ккал (3 кДж) на одну CH2-группу
В зависимости от прочности связи «вещество—рецептор» различают обратимое действие (характерное для большинства веществ) и необратимое (как правило, в случае ковалентной связи).
Если вещество взаимодействует только с функционально однозначными рецепторами определенной локализации и не влияет на другие рецепторы, то действие такого вещества считают избирательным. Так, некоторые курареподобные средства довольно избирательно блокируют холинорецепторы концевых пластинок, вызывая расслабление скелетных мышц. В дозах, оказывающих миопаралитическое действие, на другие рецепторы они влияют мало.
Основой избирательности действия является сродство (аффинитет) вещества к рецептору. Это обусловлено наличием определенных функциональных группировок, а также общей структурной организацией вещества, наиболее адекватной для взаимодействия с данным рецептором, т.е. их комплементарностью. Нередко термин «избирательное действие» с полным основанием заменяют термином «преимущественное действие», так как абсолютной избирательности действия веществ практически не существует.
Оценивая взаимодействие веществ с мембранными рецепторами, передающими сигнал от наружной поверхности мембраны к внутренней, необходимо учитывать и те промежуточные звенья, которые связывают рецептор с эффектором. Важнейшими компонентами этой системы являются G-белки, группа ферментов (аденилатциклаза, гуанилатциклаза, фосфолипаза С) и вторичные передатчики (цАМФ, цГМФ, ИФ3, ДАГ, Са2+). Повышение образования вторичных передатчиков приводит к активации протеинкиназ, которые обеспечивают внутриклеточное фосфорилирование важных регуляторных белков и развитие разнообразных эффектов.
Большинство из звеньев этого сложного каскада может быть точкой приложения действия фармакологических веществ. Однако пока такие примеры довольно ограничены. Так, применительно к G-белкам известны только токсины, которые с ними связываются. С Gs-белком взаимодействует токсин холерного вибриона, а с Gi-белком — токсин палочки коклюша.
Имеются отдельные вещества, которые оказывают прямое влияние на ферменты, участвующие в регуляции биосинтеза вторичных передатчиков. Так, дитерпен растительного происхождения форсколин, применяемый в экспериментальных исследованиях, стимулирует аденилатциклазу (прямое действие). Фосфодиэстеразу ингибируют метилксантины. В обоих случаях концентрация цАМФ внутри клетки повышается.
Одной из важных «мишеней» для действия веществ являются ионные каналы. Прогресс в этой области в значительной степени связан с разработкой методов регистрации функции отдельных ионных каналов. Это стимулировало не только фундаментальные исследования, посвященные изучению кинетики ионных процессов, но также способствовало созданию новых лекарственных средств, регулирующих ионные токи (табл. II.4).
Уже в конце 50-х годов было установлено, что местные анестетики блокируют потенциалзависимые Nа+-каналы. К числу блокаторов Nа+-каналов относятся и многие противоаритмические средства. Кроме того, было показано, что ряд противоэпилептических средств (дифенин, карбамазепин) также блокируют потенциалзависимые Nа+-каналы и с этим, по-видимому, связана их противосудорожная активность.
В последние 30 лет большое внимание было уделено блокаторам Са2+-каналов, нарушающим вхождение ионов Са2+ внутрь клетки через потенциалзависимые Са2+-каналы. Повышенный интерес к этой группе веществ в значительной степени связан с тем, что ионы Са2+ принимают участие во многих физиологических процессах: мышечном сокращении, секреторной активности клеток, нервно-мышечной передаче, функции тромбоцитов и т.д.
Многие препараты этой группы оказались весьма эффективными при лечении столь распространенных заболеваний, как стенокардия, сердечные аритмии, артериальная гипертензия. Широкое признание получили такие препараты, как верапамил, дилтиазем, фенигидин и многие другие.
| Таблица II.4. Средства, влияющие на ионные каналы | ||
| ЛИГАНДЫ Na+-КАНАЛОВ Блокаторы Na+-каналов Местные анестетики (лидокаин, новокаин) Противоаритмические средства (хинидин, новокаинамид, этмозин) Активаторы Na+-каналов Вератридин (алкалоид, гипотензивное действие) | ЛИГАНДЫ Ca2+-КАНАЛОВ Блокаторы Ca2+-каналов Антиангинальные, противоаритмические и антигипертензивыне средства (верапамил, фенигидин, дилтиазем) Активаторы Ca2+-каналов Вау К 8644 (дигидропиридин, кардиотоническое и сосудосуживающее действие) | ЛИГАНДЫ К+-КАНАЛОВ Блокаторы К+-каналов Средство, облегчающее нервно-мышечную передачу (пимадин) Противодиабетические средства (бутамид, глибенкламид) Активаторы К+-каналов Антигипертензивные средства (миноксидил, диазоксид) |
Привлекают внимание и активаторы Са2+-каналов, например производные дигидропиридина. Подобные вещества могут найти применение в качестве кардиотоников, вазоконстрикторных средств, веществ, стимулирующих высвобождение гормонов и медиаторов, а также стимуляторов ЦНС. Пока таких препаратов для медицинского применения нет, но перспективы их создания вполне реальны.
Особый интерес представляет поиск блокаторов и активаторов Са2+-каналов с преимущественным действием на сердце, сосуды разных областей (мозга, сердца и др.), ЦНС. К этому имеются определенные предпосылки, так как Са2+-каналы гетерогенны.
В последние годы большое внимание привлекают вещества, регулирующие функцию К+-каналов. Показано, что калиевые каналы весьма разнообразны по своей функциональной характеристике. С одной стороны, это существенно затрудняет фармакологические исследования, а с другой — создает реальные предпосылки для поиска избирательно действующих веществ. Известны как активаторы, так и блокаторы калиевых каналов.
Активаторы калиевых каналов способствуют их открыванию и выходу ионов К+ из клетки. Если это происходит в гладких мышцах, то развивается гиперполяризация мембраны и тонус мышц снижается. Благодаря такому механизму действуют миноксидил и диазоксид, используемые в качестве гипотензивных средств.
Блокаторы потенциалзависимых калиевых каналов представляют интерес в качестве противоаритмических средств. Блокирующим влиянием на калиевые каналы, по-видимому, обладают амиодарон, орнид, соталол.
Блокаторы АТФ-зависимых калиевых каналов в поджелудочной железе повышают секрецию инсулина. По такому принципу действуют противодиабетические средства группы сульфонилмочевины (хлорпропамид, бутамид и др.).
Стимулирующий эффект аминопиридинов на ЦНС и нервно-мышечную передачу также связывают с их блокирующим влиянием на калиевые каналы.
Таким образом, воздействие на ионные каналы лежит в основе действия различных лекарственных средств.
Важной «мишенью» для действия веществ являются ферменты. Ранее уже отмечалась возможность воздействия на ферменты, регулирующие образование вторичных передатчиков (например, цАМФ). Установлено, что механизм действия нестероидных противовоспалительных средств обусловлен ингибированием циклооксигеназы и снижением биосинтеза простагландинов. В качестве гипотензивных средств используются ингибиторы ангиотензинпревращающего фермента (каптоприл и др.). Хорошо известны антихолинэстеразные средства, блокирующие ацетилхолинэстеразу и стабилизирующие ацетилхолин.
Противобластомное средство метотрексат (антагонист фолиевой кислоты) блокирует дигидрофолатредуктазу, препятствуя образованию тетрагидрофолата, необходимого для синтеза пуринового нуклеотида — тимидилата. Противогерпетический препарат ацикловир, превращаясь в ацикловиртрифосфат, ингибирует вирусную ДНК-полимеразу.
Еще одна возможная «мишень» для действия лекарственных средств — это транспортные системы для полярных молекул, ионов, мелких гидрофильных молекул. К ним относятся так называемые транспортные белки, переносящие вещества через клеточную мембрану. Они имеют распознающие участки для эндогенных веществ, которые могут взаимодействовать с лекарственными средствами. Так, трициклические антидепрессанты блокируют нейрональный захват норадреналина. Резерпин блокирует депонирование норадреналина в везикулах. Одно из значительных достижений — создание ингибиторов протонового насоса в слизистой оболочке желудка (омепразол и др.), которые показали высокую эффективность при язвенной болезни желудка и двенадцатиперстной кишки, а также при гиперацидном гастрите.
В настоящее время важной «мишенью» для действия веществ считаются гены. В идеале необходимы препараты, с помощью которых можно было бы регулировать активность генов, а также восстанавливать их нарушенную в результате мутаций функцию. Однако эта задача достаточно сложна в связи с отсутствием необходимой информации о генетическом контроле физиологических функций. Тем не менее для моногенно контролируемых процессов эти исследования находят практическое воплощение с использованием методов генной инженерии, обеспечивающих синтез необходимого продукта внутри организма, путем создания искусственных последовательностей нуклеотидов, способных как усилить, так и снизить синтез определенного пептида.
Одно из направлений генной терапии связано с созданием так называемых антисенсовых олигонуклеотидов, которые реализуют свое действие на уровне транскрипции и трансляции. Последние представляют собой относительно короткие цепочки нуклеотидов (из 15—25 оснований), которые комплементарны той зоне нуклеиновых кислот, где находится ген-«мишень». В результате взаимодействия с антисенсовым олигонуклеотидом экспрессия данного гена подавляется. Этот принцип действия представляет интерес при лечении опухолевых заболеваний и некоторых инфекций (в частности, ВИЧ-инфекции). Создан первый препарат из группы антисенсовых олигонуклеотидов — витравен. Его используют для лечения ретинита при цитомегаловирусной инфекции.
Таким образом, возможности для направленного воздействия лекарственных средств весьма разнообразны.
6. ЗАВИСИМОСТЬ ФАРМАКОТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА
ОТ СВОЙСТВ ЛЕКАРСТВЕННЫХ СРЕДСТВ И УСЛОВИЙ ИХ ПРИМЕНЕНИЯ
А) ХИМИЧЕСКОЕ СТРОЕНИЕ, ФИЗИКО-ХИМИЧЕСКИЕ И ФИЗИЧЕСКИЕ СВОЙСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ
Свойства лекарственных средств в значительной степени обусловлены их химическим строением, наличием функционально активных группировок, формой и размером их молекул. Для эффективного взаимодействия вещества с рецептором необходима такая структура лекарственного средства, которая обеспечивает наиболее тесный его контакт с рецептором. От степени сближения вещества с рецептором зависит прочность межмолекулярных связей. Так, известно, что при ионной связи электростатические силы притяжения 2 разноименных зарядов обратно пропорциональны квадрату расстояния между ними, а ван-дер-ваальсовы силы обратно пропорциональны 6—7-й степени расстояния (см. табл. II.3).
Для взаимодействия вещества с рецептором особенно важно их пространственное соответствие, т.е. комплементарность. Это подтверждается различиями в активности стереоизомеров. Так, по влиянию на артериальное давление D(+)-адреналин значительно уступает по активности L(-)-адреналину. Различаются эти соединения пространственным расположением структурных элементов молекулы, что имеет решающее значение для их взаимодействия с адренорецепторами.
Если вещество имеет несколько функционально активных группировок, то необходимо учитывать расстояние между ними. Так, в ряду бис-четвертичных аммониевых соединений (CH3)3N+—(CH2)n—N+(CH3)3 • 2Х- для ганглиоблокирующего действия оптимально n =6, а для блока нервно-мышечной передачи — n =10 и 18. Это свидетельствует об определенном расстоянии между анионными структурами н-холинорецепторов, с которыми происходит ионная связь четвертичных атомов азота. Для таких соединений имеют также большое значение радикалы, «экранирующие» катионные центры, величина положительно заряженного атома и концентрация заряда, а также строение молекулы, соединяющей катионные группировки.
Выяснение зависимости между химической структурой веществ и их биологической активностью является одним из наиболее важных направлений в создании новых препаратов. Кроме того, сопоставление оптимальных структур для разных групп соединений с одинаковым типом действия позволяет составить определенное представление об организации тех рецепторов, с которыми взаимодействуют данные лекарственные средства.
Многие количественные и качественные характеристики действия веществ зависят также от таких физико-химических и физических свойств, как растворимость в воде, липидах, для порошкообразных соединений — от степени их измельчения, для летучих веществ — от степени летучести и т.д. Важное значение имеет степень диссоциации. Например, миорелаксанты, относящиеся по структуре к вторичным и третичным аминам, менее ионизированы и менее активны, чем полностью ионизированные четвертичные аммониевые соединения.
Б) ДОЗЫ И КОНЦЕНТРАЦИИ
Действие лекарственных средств в большой степени определяется их дозой. В зависимости от дозы (концентрации) меняются скорость развития эффекта, его выраженность, продолжительность, иногда характер. Обычно с повышением дозы (концентрации) уменьшается латентный период и увеличиваются выраженность и длительность эффекта.
Дозой называют количество вещества на один прием (обычно обозначается как разовая доза).
Необходимо быть ориентированным не только в дозе, рассчитанной на однократный прием (pro dosi), но и в суточной дозе (pro die).
Обозначают дозу в граммах или долях грамма. Для более точной дозировки препаратов рассчитывают их количество на 1 кг массы тела (например, мг/кг, мкг/кг). В отдельных случаях предпочитают дозировать вещества, исходя из величины поверхности тела (на 1 м2).
Минимальные дозы, в которых лекарственные средства вызывают начальный биологический эффект, Называют пороговыми, или минимальными действующими. В практической медицине чаще всего используют средние терапевтические дозы, в которых препараты у преобладающего большинства больных оказывают необходимое фармакотерапевтическое действие. Если при их назначении эффект выражен недостаточно, дозу повышают до высшей терапевтической. Кроме того, выделяют токсические дозы, в которых вещества вызывают опасные для организма токсические эффекты, и смертельные дозы (рис. II.12).
В некоторых случаях указывается доза препарата на курс лечения (курсовая доза). Это особенно важно при применении противомикробных химиотерапевтических средств.
Если возникает необходимость быстро создать высокую концентрацию лекарственного вещества в организме, то первая доза (ударная) превышает последующие.
Для веществ, вводимых ингаляционно (например, газообразные и летучие средства для наркоза), основное значение имеет их концентрация во вдыхаемом воздухе (обозначается в объемных процентах).
В) ПОВТОРНОЕ ПРИМЕНЕНИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
При повторном применении лекарственных средств действие их может изменяться в сторону как нарастания, так и уменьшения эффекта.
Увеличение эффекта ряда веществ связано с их способностью к кумуляции. Под материальной кумуляцией имеют в виду накопление в организме фармакологического вещества. Это типично для длительно действующих препаратов, которые медленно выделяются или стойко связываются в организме (например, некоторые сердечные гликозиды из группы наперстянки). Накопление вещества при повторных его назначениях может быть причиной токсических эффектов. В связи с этим дозировать такие препараты нужно с учетом кумуляции, постепенно уменьшая дозу или увеличивая интервалы между приемами препарата.
Известны примеры и так называемой функциональной кумуляции, при которой «накапливается» эффект, а не вещество. Так, при алкоголизме нарастающие изменения функции ЦНС могут приводить к развитию белой горячки. В данном случае вещество (спирт этиловый) быстро окисляется и в тканях не задерживается. Суммируются лишь его нейротропные эффекты. Функциональная кумуляция происходит также при применении ингибиторов МАО.
Снижение эффективности веществ при их повторном применении — привыкание (толерантность) — наблюдается при использовании разнообразных препаратов (анальгетики, гипотензивные, слабительные средства и др.). Оно может быть связано с уменьшением всасывания вещества, увеличением скорости его инактивации и (или) повышением интенсивности выведения. Возможно, что привыкание к ряду веществ обусловлено снижением чувствительности к ним рецепторных образований или уменьшением их плотности в тканях.
В случае привыкания для получения исходного эффекта дозу препарата необходимо повышать или одно вещество заменять другим. При последнем варианте следует учитывать, что существует перекрестное привыкание к веществам, взаимодействующим с теми же рецепторами (субстратами).
Особым видом привыкания является тахифилаксия — привыкание, возникающее очень быстро, иногда после 1-го введения вещества. Так, эфедрин при повторном применении с интервалом 10—20 мин вызывает меньший подъем артериального давления, чем при 1-й инъекции.
К некоторым веществам (обычно к нейротропным) при их повторном введении развивается лекарственная зависимость (табл. II.5). Она проявляется непреодолимым стремлением к приему вещества, обычно с целью повышения настроения, улучшения самочувствия, устранения неприятных переживаний и ощущений, в том числе возникающих при отмене веществ, вызывающих лекарственную зависимость. Различают психическую и физическую лекарственную зависимость. В случае психической лекарственной зависимости прекращение введения препаратов (например, кокаина, галлюциногенов) вызывает лишь эмоциональный дискомфорт.
| Таблица II.5. Примеры веществ, вызывающие лекарственную зависимость | |||
| Вещества | Лекарственная зависимость | Привыкание | |
| психическая | физическая | ||
| Морфин, героин, кодеин и другие морфиноподобные препараты | + | + | + |
| Барбитураты | + | + | + |
| Бензодиазепины | + | + | + |
| Спирт этиловый | + | + | + |
| Кокаин | + | – | – |
| Индийская конопля (марихуана, гашиш) | + | – | ± |
| ЛСД-25 (диэтиламид лизергиновой кислоты) | + | – | + |
При приеме некоторых веществ (морфин, героин) развивается физическая лекарственная зависимость. Это более выраженная степень зависимости. Отмена препарата в данном случае вызывает тяжелое состояние, которое, помимо резких психических изменений, проявляется разнообразными и часто серьезными соматическими нарушениями, связанными с расстройством функций многих систем организма вплоть до смертельного исхода. Это так называемый синдром абстиненции, или явления лишения.
Профилактика и лечение лекарственной зависимости являются серьезной медицинской и социальной проблемой.
Г) ВЗАИМОДЕЙСТВИЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ
В медицинской практике часто используют несколько лекарственных средств одновременно. При этом они могут взаимодействовать друг с другом, изменяя выраженность и характер основного эффекта, его продолжительность, а также усиливая или ослабляя побочные и токсические влияния.
Взаимодействие лекарственных средств можно классифицировать следующим образом.
- Фармакологическое взаимодействие:
1) основанное на изменении фармакокинетики лекарственных средств;
2) основанное на изменении фармакодинамики лекарственных средств;
3) основанное на химическом и физико-химическом взаимодействии лекарственных средств в средах организма.
- Фармацевтическое взаимодействие.
Комбинации различных лекарственных средств нередко используют для усиления или сочетания эффектов, полезных для медицинской практики. Например, применяя некоторые психотропные средства совместно с опиоидными анальгетиками, можно существенно повысить болеутоляющее действие последних. Есть препараты, содержащие антибактериальные или противогрибковые средства со стероидными противовоспалительными веществами, что также относится к числу целесообразных комбинаций. Таких примеров немало. Вместе с тем при сочетании веществ может возникать и неблагоприятное взаимодействие, которое обозначается как несовместимость лекарственных средств. Проявляется несовместимость ослаблением, полной утратой или изменением характера фармакотерапевтического эффекта либо усилением побочного или токсического действия. Это может происходить при совместном применении 2 или более лекарственных средств (так называемая фармакологическая несовместимость). Например, несовместимость лекарственных средств может быть причиной кровотечений, гипогликемической комы, судорог, гипертензивного криза, панцитопении и др. Несовместимость возможна также при изготовлении и хранении комбинированных препаратов (фармацевтическая несовместимость).
Date: 2015-07-01; view: 1667; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |