
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вольтамперомерия
В отличие от метода потенциометрического анализа вольтамперометрия основана на электродных реакциях протекающих за счет приложенного из вне постоянного тока.
Явления на электродах электролитической ячейки при прохождении постоянного электрического тока.
Перенос электричества осуществляется:
■ по металлическим проводам и электродам – за счет направленного перемещения электронов;
■ в растворе электролита – вследствие миграции ионов. При этом катионы движутся к отрицательно заряженному электроду (катоду), а анионы перемещаются к положительно заряженному электроду (аноду).
■ через межфазную границу «электрод – электролит» - за счет электродных окислительно - восстановительных реакций.
Вспомним кратко, какие процессы протекают в электролитической ячейке, заполненной водным раствором 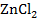 , в который опущены цинковый и платиновый электроды.
, в который опущены цинковый и платиновый электроды.
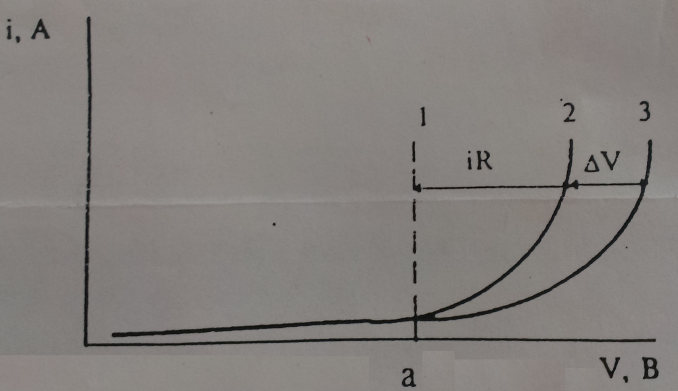
Рисунок 13 – Вольтамперные кривые
Если мы приложим к электродам ячейки достаточную разность потенциалов, то на катоде начнется выделение металлического цинка
Zn2+ +2е 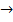 Zn°
Zn°
на нерастворимом аноде будет выделяться хлор:
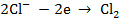
Для разряда каждого вида иона на электроде должен быть достигнут потенциал его выделения. Всегда на катоде электроны переходят к ионам, а на аноде - от ионов к электроду.
Для прохождения постоянного тока через ячейку на ее электроды нужно подавать необходимое напряжение, определяемое по формуле:
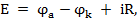
где, Е - напряжение на клеммах; В
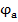 - электродный потенциал анода, В;
- электродный потенциал анода, В;
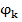 - электродный потенциал катода, В;
- электродный потенциал катода, В;
iR - падение напряжения в электролите между электродами, В.
Практически же получается, что к электродам ячейки необходимо приложить большее напряжение, чем рассчитанное по формуле.
На электроды электролитической ячейки подают напряжение, то ток практически 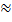 0, т. к. не достигнуты потенциалы выделения веществ (точка «а»), на электродах найдут электродные реакции, увеличение напряжения повлечет увеличение тока. Т.к. раствор электролита обладает некоторым сопротивлением, происходит паление напряжения (iR) и сила тока должна пойти не по прямой «1», а по кривой «2». В действительности увеличение силы тока идет по кривой «3», т. е. реальный ход «I-V» кривой будет отличаться от расчетного на величину
0, т. к. не достигнуты потенциалы выделения веществ (точка «а»), на электродах найдут электродные реакции, увеличение напряжения повлечет увеличение тока. Т.к. раствор электролита обладает некоторым сопротивлением, происходит паление напряжения (iR) и сила тока должна пойти не по прямой «1», а по кривой «2». В действительности увеличение силы тока идет по кривой «3», т. е. реальный ход «I-V» кривой будет отличаться от расчетного на величину  V.
V.
С увеличением напряжения будет возрастать потенциал рабочего микроэлектрода. Измерив силу тока, проходящего через ячейку и построив зависимость силы тока i от потенциала 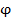 , получим кривую, которая называется полярографической волной (Рис.29).
, получим кривую, которая называется полярографической волной (Рис.29).
Небольшой ток на участке I обусловлен разрядов более положительных, чем ионы анализируемого вещества примесей и называется остаточным током.
При дальнейшем увеличении напряжения на клемах ячейки достигается потенциал разряда (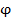 ) на рабочем микроэлектроде начинают разряжаться исследуемые ионы. В результате ток резко возрастает (участок II). Это так называемый Фарадеевский ток. Он увеличивается до некоторого предельного значения, и с дальнейшим ростом потенциала его значение остается практически постоянным (участок III). Возникает предельный ток диффузии (I пред. диф.).
) на рабочем микроэлектроде начинают разряжаться исследуемые ионы. В результате ток резко возрастает (участок II). Это так называемый Фарадеевский ток. Он увеличивается до некоторого предельного значения, и с дальнейшим ростом потенциала его значение остается практически постоянным (участок III). Возникает предельный ток диффузии (I пред. диф.).
Величина предельного тока диффузии будет пропорциональны концентрации анализируемых ионов, вступивших в электрохимическую реакцию на рабочем микроэлектроде.
Полярографическая волна (или полярограмма) содержит ценную аналитическую информацию. На ней определяют величину потенциала полуволны 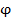 1/2 и значение I пред. диф.
1/2 и значение I пред. диф. 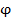 1/2 наз. потенциал середины полярографической волны (точка т). Он зависит только от природы ионов и не зависит от концентрации каждый ион имеет свой
1/2 наз. потенциал середины полярографической волны (точка т). Он зависит только от природы ионов и не зависит от концентрации каждый ион имеет свой 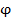 1/2, поэтому по табличным данным можно определить ионы каждого вещества участвуют в электрохимической реакции.
1/2, поэтому по табличным данным можно определить ионы каждого вещества участвуют в электрохимической реакции.
Т.о по величине 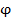 1/2 можно провести качественный анализ исследуемого раствора, а по значению предельного тока диффузии количественный анализ.
1/2 можно провести качественный анализ исследуемого раствора, а по значению предельного тока диффузии количественный анализ.
Если растовр электролита содержит ионы нескольких веществ, способных восстанавливаться на рабочем микрокатоде, то полярограмма может иметь несколько волн (рис. 30). Определив 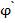 1/2,
1/2, 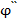 1/2... по таблице идентифицируем ионы, а по значениям
1/2... по таблице идентифицируем ионы, а по значениям 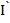 пр. диф.,
пр. диф., 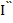 пр. диф.... определяем концентрацию. Однако чтобы полярографические волны не сливались, необходимо, чтобы потенциалы разряда определяемых ионов отличались от не менее чем на 100-150 мВ.
пр. диф.... определяем концентрацию. Однако чтобы полярографические волны не сливались, необходимо, чтобы потенциалы разряда определяемых ионов отличались от не менее чем на 100-150 мВ.
Методы вольтамперометрического анализа
Качественный анализ по потенциалу полуволны затруднений не вызывает. Для проведения количественного анализа по величине I пред. диф. Существует ряд методов.
Метод расчета о предев I пред. диф. по уравнению Ильковича определяют концентрацию анализируемого вещества.
С= I пред. диф. /607nD1/2*m1/3* 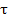 1/6, где, m - масса ртути, мг, вытек. За 1с.
1/6, где, m - масса ртути, мг, вытек. За 1с.
т - время образования капли, с D - коэффициент диффузии, см2 *е,
n - заряд иона
Этот метод на практике применяется редко.
Метод калибровочных кривых.
Готовят ряд эталонных растворов определенного вещества. Смотрят калибровочный график в координатах «h-с», где h - высота вольтамперометрической кривой, равная величине I пред. диф.
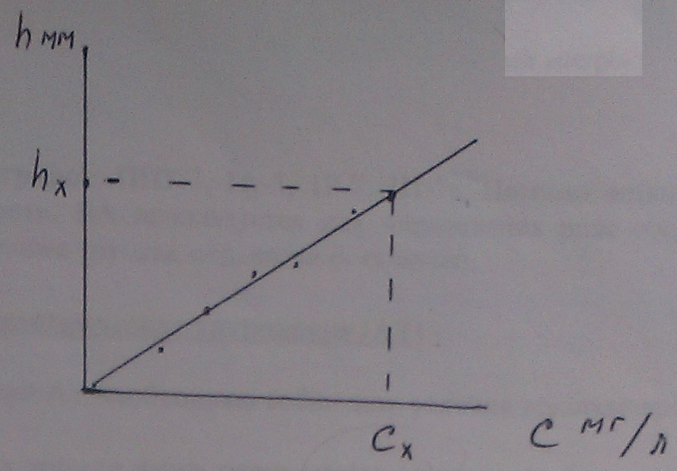
Рисунок 14
с I концентрация моль/л. Затем снимают вольтамперометрическую кривую исследуемого вещества и определив ее высоту hx, по калибровочному графику концентрацию 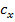 .
.
Метод стандарта.
Готовят один эталонный раствор, снимают его вольтамперную кривую и такую же кривую для анализируемого раствора. Зная концентрацию (с „) и определив Щ и анализируемого раствора hX) можно рассчитать по формуле Сх Ьх*Сст/Ьст
Метод добавок.
Сначала снимают в А кривую анализируемого раствора, затем в ячейку прибавляют по каплям стандартный раствор определенного иона с таким расчетом, чтобы высота волны возрасла вдвое. Снимают ВА кривую полученного раствора и делают расчет по формуле:
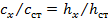 ;
; 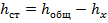 ,
,
где 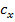 - конц. анализ, иона, мл/л
- конц. анализ, иона, мл/л
hx - высота волны анализируемого иона, мм
сст- концентрация добавленного раствора и первоначального, мг/л
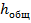 - суммарная высота волны после.
- суммарная высота волны после.
Концентрация определяемого иона вычисляем по формуле:
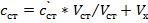
где 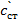 - первоначальная концентрация стандартного раствора;
- первоначальная концентрация стандартного раствора;
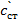 - концентрация иона после добавления ст. раствора;
- концентрация иона после добавления ст. раствора;
Vx - объем анализируемого раствора в ячейке;
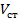 - объем добавленного стандартного раствора.
- объем добавленного стандартного раствора.
Аппаратура.
Для проведения вольтамперометрического анализа необходимы электролитическая ячейка и прибор - полярограф.
Электролитическая ячейка состоит из стеклянного сосуда емкостью от 1 до 50 мл с погруженным в него рабочим микроэлектродом и вспомогательным электродом. Микроэлектродом служит либо ртутная капля, либо такие металлы, как Pt, Au, Ag и т.п., а также графит специальной обработки. В качестве вспомогательного электрода, используют слой ртути с большей поверхностью, либо электроды сравнения (каломельный, хлор - серебряный).
Полярограф представляет собой прибор, поляризующий электроды ячейки постоянно изменяющимся напряжением и в то же время регистрирующий изменение силы тока в ячейке от подавляемого напряжения.
В ходе анализа вольтамперная кривая записывается пером на диаграммной бумажной ленте, которая перемещается на экране осциллографа. Определяют 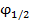 и In- ред. диф.
и In- ред. диф.
Марки полярографов: ППТ-1, Пу-1, 1Р-7, 1П-7е. Помимо анализов растворов неорганических веществ, ВА используется для определения ряда органических веществ (сод. Карбонильные группы, с=с, связи с- галоген).
Амперометрическое титрование (АТ)
При проведении АТ необходимо соблюдать условия вольтамперометрического анализа:
1. один из электродов должен иметь очень малую поверхность (индикаторный микроэлектрод), поверхность другого электрода должна быть велика (вспомогательный электрод). В этом случае поляризуется только индикаторный микроэлектрод, потенциал вспомогательного электрода остается практически постоянным;
2. в исследуемый раствор необходимо вводить фоновый электролит (в результате этого падения напряжения IR в электролите можно пренебрегать);
3. ионы определяемого вещества должны восстанавливаться или окисляться на индикаторном микроэлектроде.
Дополнительным условием для проведения амперометрического титрования (АТ) является то, что оно проводится при потенциале предельного тока диффузии (In- ред. диф.). Изменение последнего в процессе титрования раствора является аналитическим сигналом в этом методе анализа. В соответствии с уравнением Ильковича Iпред. диф. = к*с, величина Iпред. диф пропорциональна концентрации вещества раствора. Т.о. изменение концентрации иона в растворе повлечет изменение Iпред. диф.
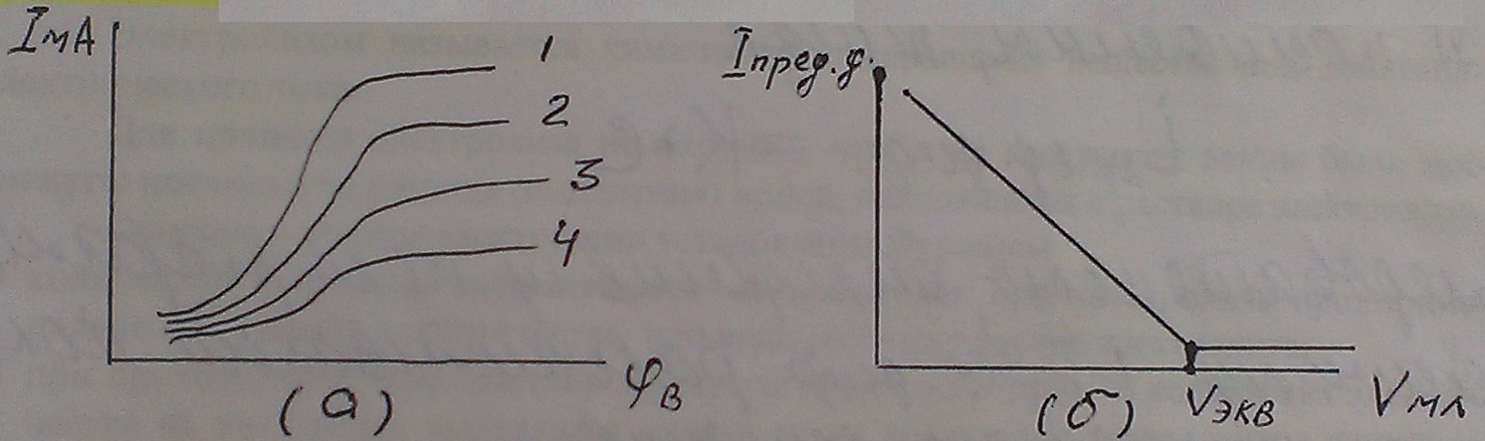
Рисунок 15
а - вольтамперные кривые при различной концентрации вещества а растворе,
б - кривая амперометрического титрования.
В процессе амперометрического титрования происходит увеличение объема раствора. Чтобы не вводить поправку на изменение объема, концентрация титранта должна быть в 10-20 раз выше концентрации исследуемого вещества.
Аппаратура
Установка для АТ компактна. В нее входят источник постоянного тока (1), потенциометр или магазин переменного сопротивления (2), вольтметр постоянного тока (3), микроамперметр постоянного тока (4), микробюретка (5), электролитическая ячейка с индикаторным электродом (6) и вспомогательным электродом (7), магнитная мешалка (8).
Установив потенциометром (2) на вольтметре (3) значение потенциала предельного тока диффузии определяемого иона, в ячейку добавляют титрант и следят за показаниями микроамперметра. Строят график в координатах «I пред, диф - Умл» и определяют эквивалентный объем титранта, пошедшего на титрование, рассчитывают концентрацию исследуемого вещества по формуле:
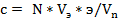 ,
,
где с - концентрация вещества, г/л,
N - нормальность титранта, г.экв./л,
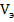 -объем титранта, мл,
-объем титранта, мл,
э - эквивалент исследуемого вещества,
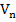 - объем пробы, мл.
- объем пробы, мл.
Аналитические возможности метода АТ широки. Этим методом можно определить практически все элементы периодической системы и большое количество органических соединений, используя реакции осаждения, комплексообразования, окисления, восстановления и кислотно - основного взаимодействия. Нижний предел определяемых концентраций 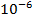 моль/л. Метод прост и не требует сложной аппаратуры.
моль/л. Метод прост и не требует сложной аппаратуры.
Кулонометрия,
Объединяет методы анализа, основанные на измерении количества электричества, затраченного на электрохимическую реакцию определяемого иона. Аналитическим сигналом является сила тока, проходящего через электролитическую ячейку в процессе электролиза.
Электролизом называется химические превращения вещества под действием электрического тока.
Для процесса электролиза необходимо, чтобы на электродах ванны были достигнуты потенциалы разряда (выделения) ионов, находящихся в растворе электролита. Основные законы электролиза установлены Фарадеем:
■ количество вещества, выделившееся на электродах при электролизе пропорционально количеству электричества, прошедшему через раствор электролита;
■ при прохождении через раствор электролита одного и того же количества электричества на электродах выделяется одно и то же количество эквивалентов вещества. Эти законы выражаются формулой:
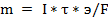 ,
,
где  - масса выделившегося вещества, г.
- масса выделившегося вещества, г.
I - сила тока прошедшего через электролит, А
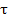 - время, с
- время, с
э - г-экв. вещества
F- число, или постоянная, Фарадея = 96496 Кл.
При прохождении через раствор электролита к-ва электричества, = 1 Фарадею, на электродах должен выделиться 1 г-экв. вещества. На практике за счет побочных реакций m практ. может быть меньше m теор. Обычно в электролизе используется величина, называемая «выход по току»:
А =  практ./
практ./ 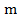 теор.*100%
теор.*100%
Прошедшее к-во электричества измеряется с помощью кулометров. Кулонометр представляет собой электрохимическую ванну, в которой протекает хорошо известная электрохимическая реакция со 100% - ным выходом по току. Кулометр включает параллелью с электрохимической ванной, в которой залит анализируемый раствор. Через анализируемы раствор и кулонометр пройдет одно и тоже количество электричества.
Зная количество (массу) выделившегося на электроде кулонометра вещества можно рассчитать количество электричества:
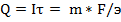 ,
,
В зависимости от способа измерения различают кулонометры: электрогравиметрические, газовые, электронные. Электронный кулонометр непосредственно отсчитывает число кулонов. Кулоносетрия основана на законах Фарадея. Если известны количество электричества и природа вещества, можно определить весовое содержание или концентрацию определяемого вещества в растворе. При этом необходимо, чтобы процесс протекал со 100% - ным выходом по току. В зависимости от происходящих в растворе процессов различают прямую кулонометрию и косвенную (кулонометрическое титрование). В прямой кулонометрии определяемое вещество подвергается непосредственному электрохимическому превращению. В свою очередь, прямая кулонометрия подразделяется на потенциостатическую и амперостатическую кулонометрию.
В первом случае анализ выполняется при поддержании постоянного значения потенциала рабочего электрода, во втором - при постоянной величине тока.
Об окончании процесса электролиза можно судить по резкому уменьшению тока (практически до 0), регистрируемого миллиамперметром (это при потенциостатическом методе).
В куллонометрическом титровании определяемое вещество «А» может быть неэлектроактивным. В электрохимическую реакцию на рабочем электроде вступает вспомогательный реагент «В», добавляемый в ячейку, которая например, восстанавливается до промежуточного реагента с, В+е 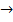 с, затем происходит химическая реакция А+с
с, затем происходит химическая реакция А+с  Ас, т. о. Кулонометрическое титрование основано на электрохимическом получении промежуточного реагента, стехиометрически вступающего в химическую реакцию с определенным веществом. Электролиз ведут при постоянной силе тока. Количество электричества определяют по формуле:
Ас, т. о. Кулонометрическое титрование основано на электрохимическом получении промежуточного реагента, стехиометрически вступающего в химическую реакцию с определенным веществом. Электролиз ведут при постоянной силе тока. Количество электричества определяют по формуле: 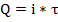
рисунок
Чтобы изменение концентрации вспомогательного реагента было незначительным, его берут в 1000- кратном избытке по отношению определенному веществу. При этом обеспечивается 100%-ный выход по току.
Аппаратура
Для поддержания постоянного потенциала указанные выше потенциостаты тоже используются, т.к. они могут работать как в потенциометрическом, так и в гальва- ностатическом режимах.
По сравнению с другими физико - химическими методами кулонометрический анализ имеет ряд преимуществ:
· возможность определения различных веществ в широком диапазоне концентраций;
· высокой точностью и воспроизводимостью;
· высокой чувствительностью (до 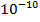 моля вещества);
моля вещества);
· возможность селективного определения веществ в их смеси.
Date: 2015-07-01; view: 497; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |