
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Окислительно-восстановительные (редокс-) потенциалы
Скачок потенциала на электроде может возникать в результате окислительно-восстановительной реакции, протекающей в приэлектродном пространстве. Если в растворе одновременно содержатся окисленная и восстановленная формы одного и того же вещества, например Fe3+ и Fe2+, то обмен электроном между окисленной (Fe3+) и восстановленной (Fe2+) формами в результате реакции Fe3+ + ē Fe2+ происходит через посредника. В качестве посредника используют инертный металл - платину. Платина способствует перераспределению электронов между восстановленной и окисленной формами данной системы. Ионы Fe2+ отдают электроны на платину, а затем они переходят на ионы Fe3+. Инертный металл не принимает участия в электродной реакции, а является переносчиком электронов. Переход электронов с Fe2+ на платину энергетически более выгоден, чем от иона Fe2+ к Fe3+ в растворе. Обмен электронами между восстановленной и окисленной формами через платину сопровождается появлением на границе раздела фаз платина - раствор двойного электрического слоя (ДЭС). Возникновение ДЭС в этом случае не связано с природой металла, а вызывается различием в способности восстановленной формы отдавать электроны посреднику, а окисленной формы - принимать электроны от посредника.
 Условная запись окислительно-восстановительного электрода.
Условная запись окислительно-восстановительного электрода.
 Fe3+
Fe3+
Pt —
Fe2+
При погружении инертного металла в раствор, содержащий избыток окисленной формы C(Fe3+)>>(Fe2+) металлическая поверхность заряжается положительно. При избытке восстановленной формы C(Fe3+)<<C(Fe2+) поверхность платины заряжается отрицательно (учебник Ершова, с. 480).
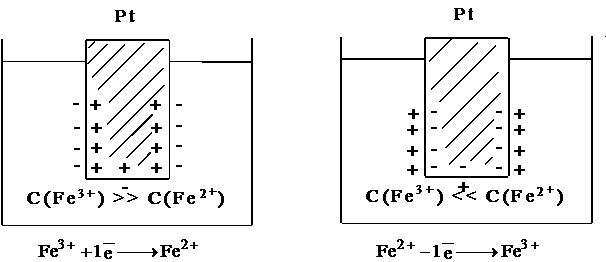 |
Т.о. окислительно-восстановительный потенциал - это потенциал, который возникает на электроде из инертного металла, погруженного в раствор, который содержит одновременно окисленную и восстановленную формы одного и того же вещества.
На величину окислительно-восстановительного потенциала влияет:
- природа окислительно-восстановительной пары,
- соотношение концентраций окисленной и восстановленной форм в растворе, температура.
Потенциал окислительно-восстановительного электрода при 298 К рассчитывают по уравнению Петерса:
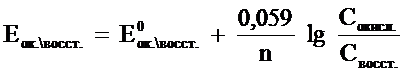
где n - число электронов, участвующих в обратимом окислительно-восстановительном процессе, протекающем на электроде.
Сокисл., Свосст. - концентрации окисленной и восстановленной форм вещества в растворе,
E0ок.\восст. - стандартный окислительно-восстановительный потенциал.
Стандартный окислительно-восстановительный потенциал — это потенциал, возникающий на границе раздела инертный металл — раствор, в котором концентрация окисленной формы равна концентрации восстановленной формы.
Величина стандартного окислительно-восстановительного потенциала является мерой окислительной способности данной системы. Чем больше положительное значение Eок.\восст., тем сильнее выражены окислительные свойства окисленной формы данной системы, т.е. способность присоединять электроны.
Date: 2015-07-17; view: 741; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |