
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Элементарная теория атома водорода
Рассмотрим применение теории Бора к атому водорода – простейшему атому с одним электроном. Ядро атома (протон) можно считать неподвижным, поскольку его масса в 1836 раз превышает массу электрона. Электронные орбиты примем за круговые. Между электроном и протоном действует сила кулоновского притяжения
 .
.
Она сообщает электрону центростремительное ускорение, удерживая его на орбите радиуса r. По второму закону Ньютона
 .
.
Кроме того, согласно третьему постулату Бора разрешенными являются орбиты, удовлетворяющие условию
 .
.
Совместное решение последних двух уравнений позволяет найти выражение для скорости электрона
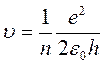
и радиуса стационарных орбит
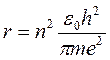 .
.
Радиусы боровских орбит пропорциональны n2. Радиус первой орбиты r1=0,0529 нм часто используют в атомной физике как единицу длины (боровский радиус, он же является размером атома водорода в основном состоянии).
Определим энергию атома водорода. Она складывается из кинетической энергии движущегося электрона (ядро считаем покоящимся) и потенциальной энергии взаимодействия электрона с ядром:
 .
.
Подставляя выражения для υ и r, получим:
 .
.
Энергия принимает отрицательные значения, что связано с выбором отсчета потенциальной энергии: Ep→0 при r→∞. Как показывают расчеты, в основном состоянии E1=-13,56 эВ. Значение E1 совпадает с работой ионизации, равной энергии связи электрона в атоме (чтобы ионизировать атом водорода нужно перевести электрон с уровня Е1 на уровень Е ∞.
В соответствии с теорией Бора величины υ, r, L и E являются квантовыми: в зависимости от значения главного квантового числа n они принимают ряд дискретных значений.
В развитии современных представлений о строении атома большую роль сыграли экспериментальные данные о спектрах излучения. Спектры невзаимодействующих атомов состоят из отдельных линий, сгруппированных в серии. Спектральной серией называется совокупность линий, положение которых в спектре подчиняется определенной закономерности. Наиболее отчетливо это проявляется в спектре простейших из атомов – атомов водорода.
Первой была обнаружена и изучена серия линий атомарного водорода в видимой и близкой ультрафиолетовой областях (Бальмер, 1885 г.). Частоты, соответствующие линиям этой серии, выражаются формулой
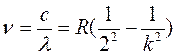 ,
,
где с – скорость света, R=3,28985•1015 с-1 – постоянная Ридберга, вычисленная из опытных данных, k – целое число, принимающее значения 3, 4, 5, …. Каждому значению k соответствует одна линия серии.
Позднее были обнаружены серии линий и в других областях спектра атомарного водорода. Все они могут быть представлены обобщенной формулой Бальмера-Ридберга
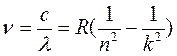 ,
,
где n – целое число, постоянное для каждой серии, а k – ряд целых чисел, начиная с k= n+1. Значению n=1 соответствует серия Лаймана (УФ-область), значениям n=3 и n=4 – серия Пашена и серия Брэкета (ИК-область) и т.д. Для энергии квантов излучения атома водорода можно записать следующую формулу:
 .
.
Дискретность в структуре атомных спектров указывает на наличие дискретности в строении самих атомов.
Энергию атома водорода в стационарном состоянии удобно представить так:
 .
.
Целое число n, определяющее энергию атома, называется главным квантовым числом. Каждому значению n соответствует свое значение энергии En. С возрастанием n энергия атома увеличивается. Состояние атома с минимальным значением энергии E1 (n=1) называется основным или нормальным, а состояния, в которых энергия En соответствует значениям n>1, – возбужденными. Основное состояние является устойчивым, а возбужденные – неустойчивыми. Совокупность значений энергии атома можно представить системой энергетических уровней. Уровни расположены неравномерно: по мере увеличения n они сгущаются. Атом испускает фотон, переходя с более высокого на нижерасположенный уровень. Переход на более высокий уровень соответствует поглощению фотона. На диаграмме, приведенной на рисунке 116, показаны положения энергетических уровней атома водорода и переходы, связанные с испусканием (по сериям спектральных линий). Группа переходов на основной уровень дает излучение, соответствующее линиям серии Лаймана. Изменения энергии при этих переходах велики (серия Лаймана располагается в УФ-области). Серия Бальмера возникает при переходах на уровень, для которого n=2 (в области видимого света), а серия Пашена – при переходах на уровень с n=3 (ИК-область) т.д.


Date: 2016-11-17; view: 811; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |