
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Краткая теория. Отношение удельной теплоемкости при постоянном давлении сp к удельной теплоемкости при постоянном объеме сv
|
|
Отношение удельной теплоемкости при постоянном давлении с p к удельной теплоемкости при постоянном объеме с v, называемое показателем адиабаты
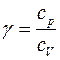 , играет в термодинамике весьма важную роль. В теории идеальных газов оно определяет число степеней свободы молекул. Это отношение входит в уравнение Пуассона, которое описывает адиабатный процесс. Этим отношением определяется скорость распространения звука в газах, от него зависит течение газов по трубам со сверхзвуковыми скоростями и другие процессы. Роль отношения
, играет в термодинамике весьма важную роль. В теории идеальных газов оно определяет число степеней свободы молекул. Это отношение входит в уравнение Пуассона, которое описывает адиабатный процесс. Этим отношением определяется скорость распространения звука в газах, от него зависит течение газов по трубам со сверхзвуковыми скоростями и другие процессы. Роль отношения 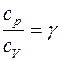 заключается еще и в том, что, зная его, можно не прибегать к измерениям с v, которые всегда трудны. Значение с V можно получить из измеренных значений с p и γ.
заключается еще и в том, что, зная его, можно не прибегать к измерениям с v, которые всегда трудны. Значение с V можно получить из измеренных значений с p и γ.
Адиабатным процессом называется процесс, осуществляющийся без теплообмена с внешней средой. Он протекает в системе, окруженной теплоизолирующей оболочкой, но его можно реализовать и при отсутствии такой оболочки. Для этого процесс должен протекать настолько быстро, чтобы за время его осуществления не произошло теплообмена между системой и окружающей средой. В настоящей лабораторной работе адиабатным можно считать быстропротекающий процесс расширения воздуха при открытом кране баллона.
В случае адиабатного процесса 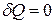 и первое начало термодинамики
и первое начало термодинамики 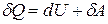 примет вид
примет вид 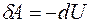 , т.е. при адиабатном процессе расширения газом совершается работа только за счет изменения запаса внутренней энергии. Этот процесс описывается уравнением Пуассона
, т.е. при адиабатном процессе расширения газом совершается работа только за счет изменения запаса внутренней энергии. Этот процесс описывается уравнением Пуассона
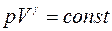 , (1)
, (1)
где р - давление; V - объём газа; γ - показатель адиабаты, равный отношению удельных теплоемкостей газа с p и с v или молярных теплоемкостей С p и С v:
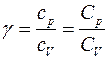 . (2)
. (2)
Выражение для γ в (2) следует из связи
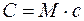 , (3)
, (3)
где М — молярная масса газа.
Удельной теплоемкостью с вещества называется физическая величина, численно равная количеству теплоты Q, необходимой для нагревания единицы массы вещества на один кельвин:
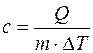 ,
, 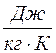 , (4)
, (4)
где m - масса вещества; DT = Т 2 - Т 1 - изменение температуры при нагревании вещества от температуры Т 1 до Т 2.
Молярной теплоемкостью С вещества называется физическая величина, численно равная количеству теплоты Q, необходимой для нагревания одного моля вещества на один кельвин:
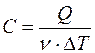 ,
, 
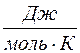 , (5)
, (5)
где ν – число молей вещества.
Для вещества в газообразном состоянии величина удельной и молярной теплоёмкостей газа существенно зависит от того, при каких условиях он нагревается: при постоянном объёме или при постоянном давлении. В первом случае сообщенное газу тепло идёт только на увеличение внутренней энергии газа, так как объём газа не изменяется и поэтому не совершается работа расширения. Во втором случае требуется дополнительное количество теплоты, необходимое для совершения работы расширения газа, так как неизменность давления обеспечивается увеличением объёма газа. Поэтому у газа различают две удельные и две молярные теплоёмкости: теплоёмкость при постоянном объёме и теплоемкость при постоянном давлении.
Удельной теплоемкостью с v газа при постоянном объёме называется физическая величина, численно равная количеству теплоты, необходимой для нагревания единицы массы на один кельвин при постоянном объёме: 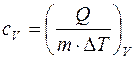 , при постоянном давлении определяется удельная теплоемкость
, при постоянном давлении определяется удельная теплоемкость 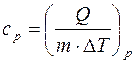 . Молярная теплоемкость (5) при постоянном объеме равна
. Молярная теплоемкость (5) при постоянном объеме равна 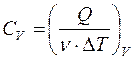 , при постоянном давлении -
, при постоянном давлении - 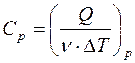 .
.
Учитывая, что для ν молей элементарное количество теплоты δQ = νCdT,
первое начало термодинамики 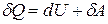 можно записать как νСdT = dU + δA, откуда следует, что
можно записать как νСdT = dU + δA, откуда следует, что 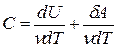 . При постоянном объеме работа газа δA = pdV= = 0 и соответствующая молярная теплоемкость равна
. При постоянном объеме работа газа δA = pdV= = 0 и соответствующая молярная теплоемкость равна 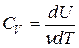 . (6)
. (6)
Здесь символ d употребляется для обозначения бесконечно малого приращения функции, а 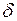 - для бесконечно малой величины. Бесконечно малое приращение внутренней энергии dU является полным дифференциалом, т.е. интеграл от dU зависит только от значений U в начальном и конечном состояниях:
- для бесконечно малой величины. Бесконечно малое приращение внутренней энергии dU является полным дифференциалом, т.е. интеграл от dU зависит только от значений U в начальном и конечном состояниях: 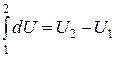 , а значит, внутренняя энергия является функцией состояния.
, а значит, внутренняя энергия является функцией состояния.
Элементарная работа  А и элементарное количество теплоты
А и элементарное количество теплоты  Q не являются полными интегралами, поэтому работа A и количество теплоты Q являются функциями процесса.
Q не являются полными интегралами, поэтому работа A и количество теплоты Q являются функциями процесса. 
Молярная теплоемкость при постоянном давлении равна
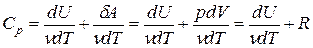 , (7)
, (7)
т.к. из уравнения Клапейрона-Менделеева PV = νRT следует, что 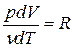 , где R = = 8,314
, где R = = 8,314 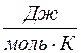 - универсальная газовая постоянная, численно равная работе изобарного расширения одного моля газа при нагревании его на один кельвин.
- универсальная газовая постоянная, численно равная работе изобарного расширения одного моля газа при нагревании его на один кельвин.
Таким образом, молярная теплоемкость С p газа при постоянном давлении больше молярной теплоёмкости C v при постоянном объёме на универсальную газовую постоянную R:
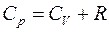 . (8)
. (8)
Это означает, что при изобарном процессе газу нужно сообщить кроме тепла, идущего на увеличение внутренней энергии, еще некоторое добавочное количество тепла, эквивалентное произведенной им внешней работе. Соотношение (8) называется уравнением Майера.
Известно, что внутренняя энергия ν молей газа определяется как U= 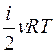 , где i – число степеней свободы молекул газа. Числом степеней свободы называется число независимых координат, описывающих положение частицы (молекулы). Из (6) следует, что молярная теплоемкость газа при постоянном объеме равна
, где i – число степеней свободы молекул газа. Числом степеней свободы называется число независимых координат, описывающих положение частицы (молекулы). Из (6) следует, что молярная теплоемкость газа при постоянном объеме равна
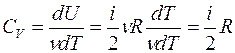 , (9)
, (9)
а с учетом уравнения Майера (8) молярная теплоемкость при постоянном давлении равна
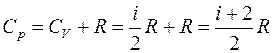 . (10)
. (10)
Для показателя адиабаты γ имеем
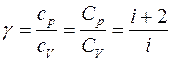 , (11)
, (11)
откуда видно, что величина g зависит только от числа степеней свободы молекул, из которых состоит газ.
Численное значение g различно для одно-, двух или многоатомных идеальных газов и зависит от числа i степеней свободы: для одноатомных i = 3, двухатомных
i = 5 и многоатомных i = 6.
Полное число степеней свободы молекулы определяется числом степеней свободы поступательного движения i пост, вращательного движения i вр и колебательного движения 2 i кол: i = i пост+ i вр+ 2 i кол. В идеальных газах не учитывается взаимодействие молекул на расстоянии, поэтому число степеней свободы колебательного движения 2 i кол (включающего равные по величине потенциальную и кинетическую энергии – отсюда множитель 2) считают равным 0.
Число поступательных степеней свободы i пост равно 3 (в трехмерном пространстве поступательное движение центра масс молекулы можно описать тремя пространственными координатами х, у и z).
Число вращательных степеней свободы i вр в общем случае равно трем, т.к. любое вращение сложной молекулы можно представить через сумму вращений вокруг трех осей х, у и z, проходящих через центр масс молекулы. Одноатомная молекула не вращается, двухатомная - имеет две оси вращения, как и трехатомная линейная молекула (например, углекислого газа СО2), для них i вр = 2, а полное число степеней свободы i = i пост+ i вр = 3 + 2 = 5. Для нелинейной молекулы из трех и более атомов число вращательных степеней свободы i вр = 3, а i = i пост+ i вр = 3 + 3 = 6.
В атмосферном воздухе суммарные объемные доли азота N2 (78,09 %) и кислорода О2 (20,95 %) составляют более 99 %, поэтому воздух можно считать состоящим из двухатомных молекул и величину i считать приближённо равной 5.
Процессы, при которых один из основных параметров состояния p, V, Т сохраняется постоянным, называются изопроцессами.
Изохорным называется процесс, протекающий при постоянном объеме V = = const, поэтому D V = dV = 0. Изохорный процесс описывается законом Гей-Люссака
 const. (12)
const. (12)
Элементарная работа в изохорном процессе равна нулю: δA = pdV= 0, следовательно, все подводимое тепло идет на повышение внутренней энергии газа: δQ = δU.
Одним из методов определения показателя адиабаты γ для воздуха является метод Клемана и Дезорма, который также называют методом адиабатного расширения. Экспериментальная установка состоит из стеклянного баллона А (рис. 1), соединен-
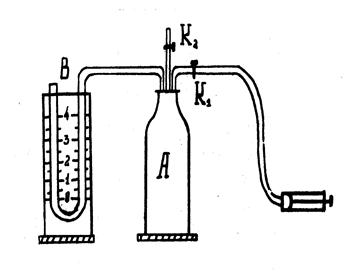 Рис. 1
Рис. 1
| Н | ного с водяным манометром В и насосом Н. Водяной U-образный манометр В измеряет избыточное, по сравнению с атмосферным, давление воздуха в баллоне А. Через кран К1 воздух нагнетается в баллон, а через кран К2 — выпускается. Если кран К2 открыт, баллон сообщается с атмосферным воздухом и давление р внутри него равно атмосферному, разность уровней воды в коленах манометра равна нулю, а температура Т в баллоне равна температуре окружающей среды. |
В процессе работы воздух, заключенный в баллоне, проходит последовательно три состояния.
1. Если закрыть кран К2 и накачать в баллон небольшое количество воздуха, то давление в баллоне станет выше атмосферного, что отмечается возникновением разности уровней воды в коленах манометра. При сжатии (накачке) воздух в баллоне нагревается выше комнатной температуры, после закрытия крана К2 начинается теплообмен с внешней средой через стенки баллона. Это процесс изохорного охлаждения, который прекращается, когда воздух в баллоне примет температуру окружающей среды T 1. При этом разность уровней в манометре станет устойчивой и равной ρgh 1, где ρ – плотность воды в манометре; g - ускорение свободного падения; h 1 – разность уровней воды в коленах манометра. Состояние I воздуха в баллоне характеризуется температурой T 1, давлением р 1= р 0 + ρgh 1, где р 0 – атмосферное давление, а ρgh 1- добавочное давление, избыточное над атмосферным.
2. Если открыть и быстро закрыть кран К2, то часть воздуха выйдет из баллона и давление сравняется с атмосферным р 0, а температура газа понизится до Т 2 < Т 1. Этот процесс расширения происходит очень быстро и может считаться адиабатным, так как за короткое время процесса не осуществляется теплообмен через стенки баллона между воздухом в баллоне и окружающей средой. Состояние газа, соответствующее концу адиабатного процесса, назовём состоянием II воздуха с давлением р 0 и температурой Т 2.
3. Охладившийся при расширении воздух в баллоне станет снова нагреваться, а давление будет возрастать при неизменном объеме. Возрастание давления в процессе изохорного нагревания прекратится, когда температура воздуха в баллоне сравняется с температурой внешней среды Т 1. Это состояние воздуха III с температурой Т 1 и давлением р 2 = р 0 + ρgh 2, где h 2 - давление в баллоне, избыточное над атмосферным в конце процесса изохорного нагревания.
Процесс адиабатного расширения I – II воздуха в баллоне происходит при переменной массе воздуха, остающегося в баллоне, поэтому удобнее перейти к переменным р и Т в уравнении Пуассона (1). Изменение массы газа никак не сказывается на вычислениях в переменных р, Т, но крайне неудобно при использовании в качестве независимой переменной объема V, занимаемого газом.
Для перехода от р,V к р, Т в (1) из уравнения Клапейрона-Менделеева
РV = νRT (13)
найдем объем 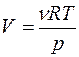 и подставим его в уравнение Пуассона (1):
и подставим его в уравнение Пуассона (1):
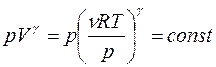 ,
,
или для процесса I – II
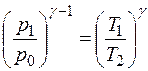 . (14)
. (14)
Процесс изохорного нагревания II – III описывается законом Гей-Люссака (12), поэтому 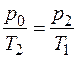 , откуда
, откуда 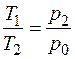 , или при возведении в степень γ имеем
, или при возведении в степень γ имеем
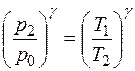 . (15)
. (15)
Т.к. уравнения (14) и (15) имеют одинаковые правые части, то равны и их левые части: 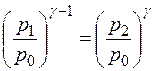 , откуда следует
, откуда следует 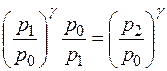 и окончательно
и окончательно
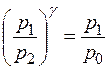 . Учитывая, что р 1= р 0 + ρgh 1, а р 2 = р 0 + ρgh 2, имеем
. Учитывая, что р 1= р 0 + ρgh 1, а р 2 = р 0 + ρgh 2, имеем

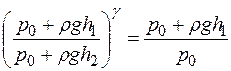 . (16)
. (16)
Прологарифмируем выражение (16): 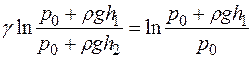 . Решая отно-
. Решая отно-
сительно γ, получим: 
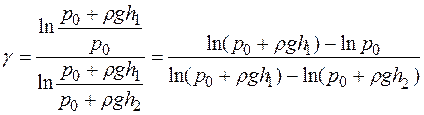 . (17)
. (17)
Так как практически давления р 0 , р 1= р 0 + ρgh 1 и р 2 = р 0 + ρgh 2 отличаются друг от друга незначительно, то в формуле (17) разности логарифмов можно принять пропорциональными разностям самих давлений и приближенно считать
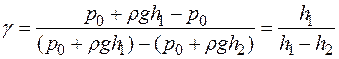 . (18)
. (18)
Таким образом, показатель адиабаты γ определяется как
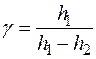
| (19) |
Date: 2015-05-08; view: 3132; Нарушение авторских прав