
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Выполнение работы. Опыт 1. Растворение оксида углерода (IV) в воде
Опыт 1. Растворение оксида углерода (IV) в воде
В пробирку налить 3-4 мл воды, добавить несколько капель синего лакмуса и пропустить в воду СO2 из аппарата Киппа.
Требование к результатам опыта:
Написать уравнение реакции взаимодействия воды с СО2 и объяснить изменение окраски лакмуса.
Опыт 2. Тушение огня оксидом углерода (IV) (групповой)
Сухой стакан наполнить СO2 из аппарата Киппа. В фарфоровую чашку, налить 15-20 капель спирта и поджечь его. Затем "вылить" из стакана СO2 на горящий спирт. Что наблюдается?
Опыт 3. Окислительные свойства оксида, углерода (IV) (групповой)
Наполнить стакан СО2. Взять щипцами ленту магния, поджечь ее на спиртовке и быстро внести в стакан с СО2, не касаясь его стенок. По окончании горения магния в стакан налить немного воды, обмыть стенки стакана, прилить несколько капель фенолфталеина. Что наблюдается?
Требования к результатам опыта:
1. Закончить уравнения реакций: Mg + CO2 =
MgO + H2O =
2. Сделать вывод об окислительных свойствах СО2.
Опыт 4. Получение кремниевой кислоты
К 1-3 мл концентрированного раствора Na2SiO3 и добавить 1-2 мл раствора HCl (1:1), перемешать стеклянной палочкой. В результате образования кремниевой кислоты содержимое пробирки застывает в виде прозрачного геля (студенистого осадка).
Требование к результатам опыта:
Написать уравнение реакции получения кремниевой кислоты.
Опыт 5. Сравнение силы угольной и кремниевой кислот
Налить в пробирку 2-3 мл раствора Na2SО3, пропустить ток СO2. Объяснить наблюдаемое.
Требование к результатам опыта:
Написать уравнение реакции взаимодействия Na2SО3 с СO2.
Опыт 6. Гидролиз силикатов
В две пробирки налить по 1-2 мл раствора силиката натрия Na2SiO3. В одну прилить несколько капель фенолфталеина. Что наблюдается? В другую пробирку добавить 2-4 мл раствора хлорида аммония NH4Cl. Определить, какой газ выделяется.
Требования к результатам опыта:
1. Составить уравнение реакции гидролиза силиката натрия.
2. Закончить уравнение реакции Na2SiO3 + NH4Cl + H2O = и объяснить образование газа.
Задачи
№ 27.1. Сколько кубических метров СО2 (н.у.) можно получить из 1 т известняка, содержащего 95 % СаСО3? (Ответ: 212,8 м3).
№ 27.2. Вычислить объем одного моля эквивалентов СО2 в реакции
С + О2 = СО2 при нормальных условиях. (Ответ: 5,6 л).
№ 27.3. Составить уравнения реакций взаимодействия: а) NaHCO3 и HCl; б) NaHCO3 и NaOH; в) Ca(HCO3)2 и NaOH; г) Ca(HCO3)2 и Ca(OH)2.
№ 27.4. Какие типы гибридизации АО характерны для углерода? Описать с позиций метода ВС строение молекул СН4, С2Н4, С2Н2.
№ 27.5. Карбид кальция получают по схеме: СаО + С → СаС2 + СО. Вычислить массу СаО, необходимую для получения 6,4 т СаС2. Какой объем СО (н.у.) при этом образуется? (Ответ: 5,6 т; 2240 м3).
№ 27.6. Вычислить энтальпию образования оксида магния, исходя из уравнения реакции CO2 + 2Mg = 2MgO + C, ΔH0 = -810 кДж.
ΔfH0 (CO2) = -393,5 кДж/моль. (Ответ: 601,8 кДж/моль).
№ 27.7. Закончить уравнения реакций: а) SiO2 + KOH =;
б) SiO2 + HF =; в) Si + NaOH + H2O =; г) SiO2 + Mg 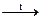
№ 27.8. Реакция протекает по уравнению Si + 2NaOH + H2O = Na2SiO3 + H2. Сколько кремния и воды потребуется для получения водорода, необходимого для наполнения воздушного шара емкостью 200 м3 (условия нормальные)? (Ответ: Si – 125 кг; Н2О – 80,3 кг).
№ 27.9. Вычислить молярную массу эквивалентов карбоната натрия при взаимодействии с кислотой, если образуется:
а) гидрокарбонат; б) угольная кислота. (Ответ: 106 г/моль; 53 г/моль).
№ 27.10. Какие вещества и в каком количестве требуются для получения 1 л SiH4 (условия нормальные)?
№ 27.11. Какие из перечисленных газов при пропускании их через раствор щелочи вступают с ней в реакцию: а) СО; б) СО2; в) HCN; г) CF4?
Составить соответствующие уравнения реакций.
№ 27.12. Вычислить энтальпию образования SiC, исходя из уравнения реакции: SiO2 + 3C = SiC + 2CO, ΔH0х.р. = 510,9 кДж.
Энтальпии образования SiO2 и СО соответственно равны -910,9 кДж/моль
и -110,5 кДж/моль. (Ответ: -179 кДж/моль).
№ 27.13. Закончить уравнения реакций:
а) CO + KMnO4 + H2SO4 = б) CO + K2Cr2O7 + H2SO4 =
№ 27.14. Через раствор, содержащий 112 г гидроксида калия, пропустили диоксид углерода, полученный при действии избытка HCl на 300 г карбоната кальция. Какая соль при этом образовалась и какова ее масса?
(Ответ: КНСО3; 200 г).
№ 27.15. Какой объем СО2 (н.у.) может дать огнетушитель, содержащий
20 л8 %-ного раствора NaHCO3 (плотность раствора 1,058 г/см3)?
(Ответ: 448 л).
№ 27.16. Состав минерала асбеста может быть выражен формулой
CaО ∙ 3MgО ∙ 4SiO2. Вычислить процентное содержание SiO2 в асбесте.
(Ответ: 57,7 %).
№ 27.17. Какой объем СО2 (условия нормальные) можно получить из 210 г
NaHCO3: а) прокаливанием; б) действием кислоты? (Ответ: 28 л; 56 л).
№ 27.18. Закончить уравнения реакций: а) CaC2 + H2O =;
б) Mg2Si + HCl =; в) CO + Fe2O3 =; г) SiO2 + Na2CO3 
№ 27.19. В пробирках находятся растворы: NaOH, NaHCO3, Na2CO3. С помощью каких реакций можно отличить их друг от друга? Составить соответствующие уравнения реакций.
№ 27.20. Закончить уравнения реакций: а) Si + HNO3 + HF =;
б) Al + C 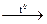 ; в) Na2SiO3 + HCl (конц.) =; г) H2SiO3 + KOH =
; в) Na2SiO3 + HCl (конц.) =; г) H2SiO3 + KOH =
Date: 2015-09-24; view: 688; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |