
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Комплексные соединения
Строение и номенклатура комплексных соединений
В XIX веке был накоплен экспериментальный материал, показывающий, что многие молекулы с уже реализованными химическими свойствами способны вступать в дальнейшие взаимодействия с образованием более сложных соединении второго порядка. К таким соединениям относятся комплексные соединения.
В 1893 г. швейцарским химиком-неоргаником Альфредом Вернером (1866–1919) была сформулирована теория, позволившая понять строение и некоторые свойства комплексных соединений и названная координационной теорией. Поэтому комплексные соединения часто называют координационными соединениями.
Соединения, в состав которых входят сложные ионы, существующие как в кристалле, так и в растворе, называются комплексными, или координационными.
Основные положения теории Вернера:
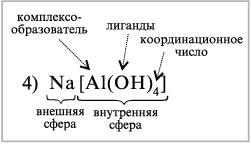
1. В составе комплексных соединений выделяют внутреннюю сферу, включающую центральный атом или ион комплексообразователя, вокруг которого находятся связанные с ним лиганды.
Внешнюю сферу комплексных соединений образуют ионы, непосредственно не связанные с комплексообразователем. Эти ионы удерживаются около внутренней сферы за счет сил электростатического взаимодействия.
3. Типичными комплексообразователями являются: атомы или ионы d-элементов, имеющие свободные орбитали (Сu+, Сu2+,Zn2+, Ni2+,Со3+, Fе2+, Fе3+, Mn2+, Pt2+ и др.). Комплексообразователи являются акцепторами электронов.
4. Лиганды - атомы, ионы, молекулы, имеющие избыток электронов или неподелённые электронные пары. Ими могут быть кислотные остатки (SO42-, CI-, NO3-), гидроксогруппы (ОН-) и нейтральные молекулы (Н2O, NН3, СО, органические вещества). Лиганды являются донорами электронов.
5. Механизмы комплексообразования связаны с возникновением межионного и межмолекулярного взаимодействий комплексообразователя с лигандами, но основной вклад в формирование внутренней сферы вносят донорно-акцепторные (координационные) взаимодействия.
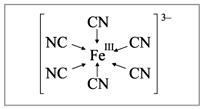
| Координация цианид-ионов вокруг иона железа |
6. Количество лигандов, связанных с комплексообразователем, определяется его координационным числом. Величина координационного числа зависит от природы комплексообразователя, лигандов и условий комплексообразования (концентрации, рН, температуры и др.)
Координационные числа наиболее распространенных комплексообразователей:
| Kоординационное число | Комплексообразователь |
| Cu+, Ag+, Au+ | |
| Cu2+, Hg2+, Sn2+, Pt2+, Pb2+, Ni2+, Co2+, Zn2+, Au3+, Al3+ | |
| Fe2+, Fe3+, Co2+, Co3+, Ni2+, Cr3+, Sn4+, Pt4+ |
Разберите состав комплексных соединений с помощью следующих примеров:
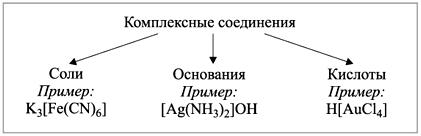
1) K4[Fe(CN)6] – гексацианоферрат(II) калия,
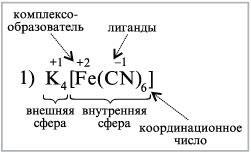
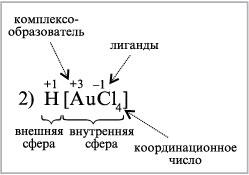
2) H[AuCl4] – тетрахлорозолотая кислота
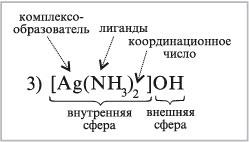
3) [Ag(NH3)2]OH – диамминсеребро(I) гидроксид
4) Na[Al(OH)4] – тетрагидроксоалюминат (III)натрия
Классификация комплексных соединений
Большое многообразие комплексных соединений и их свойств не позволяет создать единую классификацию. Однако можно группировать вещества по некоторым отдельным признакам.
1) По составу.
2) По типу координируемых лигандов.
а) Аквакомплексы – это комплексные катионы, в которых лигандами являются молекулы H2O. Их образуют катионы металлов со степенью окисления +2 и больше, причем способность к образованию аквакомплексов у металлов одной группы периодической системы уменьшается сверху вниз.
Например: [Al(H2O)6]Cl3, [Cr(H2O)6](NO3)3.
б) Гидроксокомплексы – это комплексные анионы, в которых лигандами являются гидроксид-ионы OH–. Комплексообразователями являются металлы, склонные к проявлению амфотерных свойств – Be, Zn, Al, Cr.
Например: Na[Al(OH)4], Ba[Zn(OH)4].
в) Аммиакаты – это комплексные катионы, в которых лигандами являются молекулы NH3. Комплексообразователями являются d -элементы.
Например: [Cu(NH3)4]SO4, [Ag(NH3)2]Cl.
г) Ацидокомплексы – это комплексные анионы, в которых лигандами являются анионы неорганических и органических кислот.
Например: K3[Al(C2O4)3], Na2[Zn(CN)4], K4[Fe(CN)6].
3) По характеру заряда внутренней сферы различают катионные, анионные и нейтральные комплексы.
Например:
1) [Cu+(NН3)4]+ - катионный комплекс
2) [Zn2+(SCN)4]2– - анионный комплекс
3) [ Pt2+(CI)2(Н 2 О)2]0 - нейтральный комплекс
При составлении названия комплексного соединения учитывают знак заряда внутренней сферы комплекса.
Греческим числительным указывают число лигандов и называют нейтральные лиганды:

Лиганды-анионы называют с окончанием «-о»
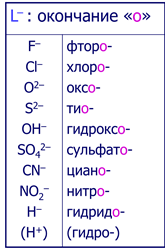
Комплексообразователь в катионных и нейтральных комплексах называют русским наименованием, а в анионных комлексах-латинским наименованием с окончанием «-ат».
Степень окисления комплексообразователя указывают римской цифрой в круглых скобках, за исключением нейтральных комплексов.
Например:
1) катионные комплексы:
[Cu2+(NH3)4]SO4 – сульфат тетраамминмедь(II);
[Al3+(H2O)6]Cl3 – хлорид гексаакваалюминий (III).
2) анионные комплексы:
[Fe3+(CN)6]3– – гексацианоферрат(III)-ион;
K2[Hg2+(I)4] – тетраиодомеркурат(II) калия;
3) нейтральные комплексы:
[Zn2+(Cl)2(H2O)2] – диаквадихлороцинк
[Pt4+(OH)2(NO2)2(NH3)2] – диамминдинитродигидроксоплатина
Значение комплексных соединений
Координационные соединения имеют исключительно большое значение в природе. Достаточно сказать, что почти все ферменты, многие гормоны, лекарства, биологически активные вещества представляют собой комплексные соединения.
Комплексы белков с катионами металлов играют роль металлоферментов, катализирующих большинство химических превращений. В качестве центрального иона металлофермента выступают катионы Mn2+,Cr2+,Fe3+, Zn2+ и др. К комплексным соединениям относятся гормон инсулин – комплекс ионов цинка с белками; витамин В12 - комплекс кобальта с порфирином.
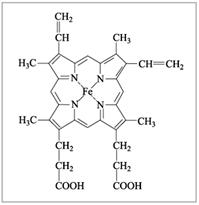
Гемоглобин крови, благодаря которому осуществляется перенос кислорода от легких к клеткам ткани, является комплексным соединением, содержащим железо Fе2+ с порфирином, а хлорофилл, ответственный за фотосинтез в растениях, – комплексным соединением магния с тем же лигандом.
|
| Гем-группа в молекуле гемоглобина |
Значительную часть природных минералов, в том числе полиметаллических руд и силикатов, также составляют координационные соединения. Более того, химические методы извлечения металлов из руд, в частности меди, вольфрама, серебра, алюминия, платины, железа, золота и других, также связаны с образованием легкорастворимых, легкоплавких или летучих комплексов. Например: Na3[AlF6] – криолит, KNa3[AlSiO4]4 – нефелин.
Комплексные соединения находят широкое применение:
- для выведения из организма камней, которые образуются в почках, мочевом пузыре, желчных протоках;
- для маскировки нежелательных примесных элементов в составе лекарственных препаратов;
- для очистки организма от ядов, радиоактивных элементов, тяжелых металлов;
- в аналитической химии для определения ионов, т.к. яркая окраска многих внутрикомплексных соединений позволяет использовать реакции их образования для обнаружения катионов металлов в анализируемом растворе;
- для разделения некоторых металлов и получения металлов высокой степени чистоты;
- для устранения жесткости воды;
- в качестве катализаторов важных биохимических процессов.
Date: 2015-09-22; view: 946; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |