
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Строение и общая характеристика реакционной способности
Пиррол, фуран и тиофен – главные представители этой группы гетероциклических соединений. Наибольшее распространение в растительном и животном мире имеют производные пиррола, являющиеся структурными фрагментами гема и хлорофиллов, пигментов желчи, ряда антибиотиков и алкалоидов. Значительно реже встречаются в природе производные фурана и тиофена, если не считать пятичленные циклические формы моносахаридов, содержащих насыщенное кольцо фурана.
3.1.1. Ароматичность.
Пятичленные гетероциклы с одним гетероатомом – пиррол, фуран и тиофен - представляют собой плоские пятиугольники с четырьмя атомами углерода и соответствующим гетероатомом – азотом, кислородом или серой.
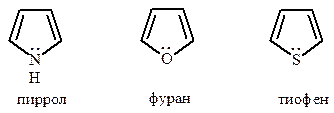
Ароматический секстет π-электронов в этих молекулах образуется за счет π-электронов атомов углерода и неподеленных электронов гетероатомов, находящихся на негибридизиованных pZ -орбиталях.
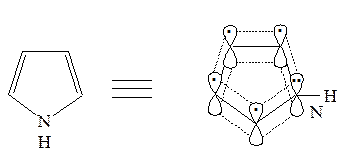
Каждый из атомов углерода и гетероатомов в этих соединениях находится в состоянии sp2 -гибридизации и имеет по одной негибридизованной 2 pZ -орбитали, ориентированной перпендикулярно плоскости цикла. Эти орбитали эффективно перекрываются и формируют ароматические секстеты π-электронов в молекулах.
Теория резонанса подтверждает ароматический характер фурана, пиррола и тиофена. Набор следующих пяти резонансных структур описывает, например, делокализацию π-электронов в основном состоянии гетероцикла.

Пиррол, фуран и тиофен относятся к π -избыточным гетероциклам, так как в них число электронов, образующих ароматическую систему, превышает общее число атомов в цикле (соотношение равно 6:5).
В целом π-баланс гетероароматической системы характеризует электронную плотность на атомах углерода кольца как единого целого и количественно оценивается как суммарный отрицательный или положительный заряд на этих атомах.
В приведенных пятичленных гетероциклах π-избыточными являются все атомы углерода. Общая π-избыточность пиррола, фурана и тиофена составляет соответственно -0,280, -0,30 и -0,292.
Поскольку пиррол, фуран и тиофен имеют сходное электронное строение, в их химическом поведении имеется много общего.
Химические превращения гетероциклов можно классифицировать следующим образом:
· кислотно-основные превращения с участием гетероатома;
· реакции присоединения;
· реакции замещения;
· реакции расширения цикла;
· реакции замены гетероатома.
Основу химии пиррола, тиофена и фурана определяет способность этих соединений с легкостью вступать в реакции электрофильного замещения, преимущественно по α-положению. Электрофильное замещение по β-положению протекает менее легко и обычно в том случае, если α-положения заняты заместителями.
3.1.2. Реакции электрофильного замещения.
Как π-избыточные соединения, эти гетероциклы легко вступают в реакции с электрофильными реагентами. В реакциях электрофильного замещения пиррол, фуран и тиофен значительно активнее бензола и пиридина. По реакционной способности они сравнимы с активированными производными бензола – фенолом и анилином. В незамещенных гетероциклах электрофильная атака осуществляется преимущественно по атому С-2 (α-положение), так как в промежуточно образующемся катионе (σ-комплексе) резонансная стабилизация эффективнее, чем в катионе при атаке β-положения.
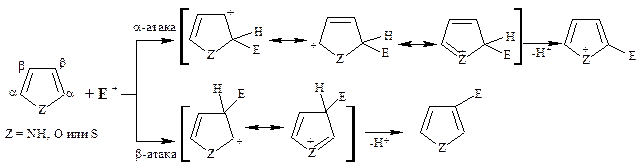
π-Избыточность пятичленных гетероциклов накладывает ограничения на условия проведения реакций с электрофильными реагентами, которые обычно осуществляются в кислой среде. В реакциях с пирролом протон как электрофил атакует не атом азота, неподеленная пара электронов которого участвует в сопряжении, а атом углерода кольца.
Аналогично пирролу ведет себя по отношению к сильным кислотам и фуран.
Свойство соединений подвергаться глубоким превращениям под действием кислот называют ацидофобностью, а сами гетероциклы – ацидофобными.
Тиофен, в отличие от пиррола и фурана, устойчив к действию сильных кислот и не относится к ацидофобным гетероциклам.
Относительная активность пятичленных гетероагентов в реакциях SE снижается в ряду:
пиррол > фуран > тиофен
Но даже тиофен значительно превосходит бензол по реакционной способности.
В связи с повышенной чувствительностью пятичленных гетероароматических соединений к сильным кислотам в ряде их реакций электрофильного замещения применяют модифицированные электрофильные реагенты. При использовании этих реагентов исключается сильнокислая среда. Ниже даны примеры таких реагентов:
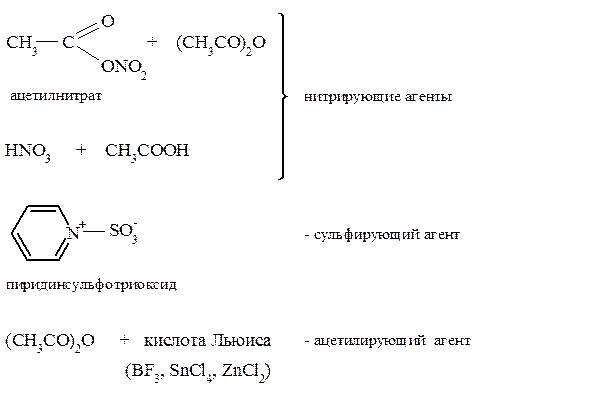
С использованием этих реагентов реакции с пятичленными гетероароматическими соединениями идут в мягких условиях и с хорошим выходом.
Date: 2015-09-26; view: 459; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |