Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Методы изучения гидрологических процессов
Содержание
Читать: Аннотация
Читать: 1. гидрология как наука
 Читать: 1.1. методы изучения гидрологических процессов
Читать: 1.1. методы изучения гидрологических процессов
 Читать: 1.2. вода как вещество
Читать: 1.2. вода как вещество
 Читать: 1.3. водный баланс в гидрологии
Читать: 1.3. водный баланс в гидрологии
 Читать: 1.4. понятие о гидросфере
Читать: 1.4. понятие о гидросфере
 Читать: 1.5. круговорот воды в природе
Читать: 1.5. круговорот воды в природе
 Читать: 1.6. понятие о водных ресурсах
Читать: 1.6. понятие о водных ресурсах
 Читать: 1.7. водные объекты и их виды
Читать: 1.7. водные объекты и их виды
Читать: 2. гидрология рек
 Читать: 2.1. реки и их типы
Читать: 2.1. реки и их типы
 Читать: 2.3. водный баланс речного бассейна
Читать: 2.3. водный баланс речного бассейна
 Читать: 2.4. строение реки
Читать: 2.4. строение реки
 Читать: 2.5. морфометрические характеристики реки и русла реки
Читать: 2.5. морфометрические характеристики реки и русла реки
 Читать: 2.6. количественные характеристики стока реки
Читать: 2.6. количественные характеристики стока реки
 Читать: 2.7. водный режим рек
Читать: 2.7. водный режим рек
 Читать: 2.8. классификация рек по водному режиму
Читать: 2.8. классификация рек по водному режиму
 Читать: 2.9. гидрометрия
Читать: 2.9. гидрометрия
 Читать: 2.10. русловые процессы на реках
Читать: 2.10. русловые процессы на реках
 Читать: 2.11. термический и ледовый режимы рек. ледовые явления
Читать: 2.11. термический и ледовый режимы рек. ледовые явления
 Читать: 2.12. гидрохимия рек
Читать: 2.12. гидрохимия рек
 Читать: 2.13. антропогенное воздействие на режим рек и речной сток
Читать: 2.13. антропогенное воздействие на режим рек и речной сток
Читать: 3. гидрология подземных вод
 Читать: 3.1. вода в земной коре
Читать: 3.1. вода в земной коре
 Читать: 3.2. интенсивность водообмена подземных вод
Читать: 3.2. интенсивность водообмена подземных вод
 Читать: 3.3. происхождение подземных вод
Читать: 3.3. происхождение подземных вод
 Читать: 3.4. водные свойства горных пород
Читать: 3.4. водные свойства горных пород
 Читать: 3.5. физические свойства и химический состав подземных вод
Читать: 3.5. физические свойства и химический состав подземных вод
 Читать: 3.6. классификация подземных вод
Читать: 3.6. классификация подземных вод
 Читать: 3.7. движение подземных вод
Читать: 3.7. движение подземных вод
 Читать: 3.8. естественные выходы подземных вод на поверхность (источники)
Читать: 3.8. естественные выходы подземных вод на поверхность (источники)
 Читать: 3.9. режим и баланс подземных вод
Читать: 3.9. режим и баланс подземных вод
 Читать: 3.10. запасы и ресурсы подземных вод
Читать: 3.10. запасы и ресурсы подземных вод
 Читать: 3.11. охрана подземных вод от истощения и загрязнения
Читать: 3.11. охрана подземных вод от истощения и загрязнения
Читать: 4. гидрология озер
 Читать: 4.1. типы озер
Читать: 4.1. типы озер
 Читать: 4.2. морфология и морфометрия озер
Читать: 4.2. морфология и морфометрия озер
 Читать: 4.3. водный баланс озер
Читать: 4.3. водный баланс озер
 Читать: 4.4. динамика уровня воды в озерах
Читать: 4.4. динамика уровня воды в озерах
 Читать: 4.5. движение воды в озерах
Читать: 4.5. движение воды в озерах
 Читать: 4.6. термический режим озер
Читать: 4.6. термический режим озер
 Читать: 4.7. ледовые явления на озерах
Читать: 4.7. ледовые явления на озерах
 Читать: 4.8. гидрохимия озер
Читать: 4.8. гидрохимия озер
 Читать: 4.9. влияние озер на речной сток
Читать: 4.9. влияние озер на речной сток
Читать: 5. гидрология водохранилищ
 Читать: 5.1. типы водохранилищ
Читать: 5.1. типы водохранилищ
 Читать: 5.2. основные морфометрические характеристики водохранилищ
Читать: 5.2. основные морфометрические характеристики водохранилищ
 Читать: 5.3. водный режим водохранилищ
Читать: 5.3. водный режим водохранилищ
 Читать: 5.4. термический режим водохранилищ
Читать: 5.4. термический режим водохранилищ
 Читать: 5.5. влияние водохранилищ на окружающую среду
Читать: 5.5. влияние водохранилищ на окружающую среду
Читать: 6. гидрология болот
 Читать: 6.1. происхождение болот
Читать: 6.1. происхождение болот
 Читать: 6.2. типы болот
Читать: 6.2. типы болот
 Читать: 6.3. морфология и гидрология болот
Читать: 6.3. морфология и гидрология болот
 Читать: 6.4. влияние болот на речной сток и хозяйственное значение болот
Читать: 6.4. влияние болот на речной сток и хозяйственное значение болот
Читать: 7. гидрология морей
 Читать: 7.1. мировой океан и его структура
Читать: 7.1. мировой океан и его структура
 Читать: 7.2. водный баланс мирового океана
Читать: 7.2. водный баланс мирового океана
 Читать: 7.3. морские течения и их классификация
Читать: 7.3. морские течения и их классификация
 Читать: 7.4. приливы и отливы
Читать: 7.4. приливы и отливы
 Читать: 7.5. динамика температуры морской воды
Читать: 7.5. динамика температуры морской воды
 Читать: 7.6. соленость морской воды
Читать: 7.6. соленость морской воды
 Читать: 7.7. океан и климат
Читать: 7.7. океан и климат
 Читать: 7.8. экологическое состояние мирового океана
Читать: 7.8. экологическое состояние мирового океана
Читать: Заключение
Читать: Библиографический список
 Читать: Основная литература
Читать: Основная литература
 Читать: Дополнительная литература
Читать: Дополнительная литература
 Читать: Интернет-ресурсы
Читать: Интернет-ресурсы
Читать: Словарь терминов
Читать: Приложение
методы изучения гидрологических процессов
Гидрология (греч. Yδρoλoγια, от др. греч. Yδωρ – вода + λoγoς – слово, учение) – наука, изучающая природные воды, их взаимодействие с атмосферой и литосферой, а также явления и процессы, в них протекающие (испарение, за- мерзание и т. п.).
В теоретическом и практическом отношении гидрология:
исследует круговорот воды в природе, влияние на него деятельности че- ловека, управление режимом водных объектов и водным режимом отдельных территорий;
проводит анализ гидрологических элементов для отдельных территорий и
Земли в целом;
дает оценку и прогноз состояния и рационального использования водных ресурсов; пользуется методами, применяемыми в географии, физике и других науках.
К основным разделам гидрогеологии относятся:
Гидрохимия изучает химические характеристики природных вод.
Гидробиология – раздел на стыке с биологией, рассматривающий вопро-
сы жизни и биологических процессов в воде.
Гидрогеология – изучает происхождение, условия залегания, состав и закономерности движений подземных вод.
Гидроинформатика – раздел на стыке с информатикой, в котором ис- пользуют современные вычислительные мощности для решения проблем, свя- занных с водными ресурсами.
Гидрометеорология – изучает обменные процессы между поверхностью воды и нижними слоями атмосферы
Изотопная гидрология – изучает изотопические характеристики воды.
Гидрология суши изучает процессы, протекающие на поверхности Земли.
Океанология – изучает характеристики больших масс воды.
Данные гидрологии моря используются при плавании и ведении боевых
действий надводными кораблями и подводными лодками [1].
Современная гидрология располагает большим арсеналом взаимодопол- няющих друг друга методов изучения гидрологических процессов. Среди них важное место занимают методы полевых исследований, которые подразделяют- ся на стационарные и экспедиционные. Большинство результатов стационар-
ных наблюдений на сети гидрологических станций и постов публикуется в ма- териалах Государственного водного кадастра (ГВК), который представляет со- бой систематизированный, постоянно пополняемый и уточняемый свод сведе- ний о водных объектах, режиме, качестве, использовании вод и составляет еди- ный Государственный водный фонд страны.
В гидрологии широко используются экспериментальные исследования (в природных условиях или в лаборатории). При анализе материалов гидрологиче- ских наблюдений используются эмпирические и статистические методы. Тео- ретические методы анализа гидрологических процессов включают приемы гео- графического обобщения, картографирования, методы математического и ими- тационного моделирования, системный анализ др.
1.2. вода как вещество
Молекулярная структура
Вода – (оксид водорода) Н20, молекулярная масса 18,016, простейшее ус-
тойчивое соединение водорода с кислородом. Жидкость без запаха, вкуса и цвета.
Вода – одно из самых распространенных на Земле соединений. Молекулы воды обнаружены в межзвездном пространстве. Вода входит в состав комет,
большинства планет солнечной системы и их спутников. Количество воды на поверхности Земли оценивается в 1,39 •1018 т, большая часть ее содержится в морях и океанах. Количество доступных для использования пресных вод в ре- ках, озерах, болотах и водохранилищах составляет около 11 • 1013 т. Масса ледников Антарктики, Антарктиды и высокогорных районов 2,4 • 1016т, при- мерно столько же имеется подземных вод, причем, только небольшая их часть – пресные. В глубинных слоях Земли содержится значительно больше (по- видимому, не менее, чем на порядок) воды, чем на поверхности. В атмосфере находится около 1,3 • 1013 т воды. Вода входит в состав многих минералов и горных пород (глины, гипс и др.), присутствует в почве, является обязательным компонентом всех живых организмов.
Изотопный состав. Существует 9 устойчивых разновидностей воды. Со-
16 1 18
держание их в пресной воде в среднем следующее (\%): 1Н2
О – 99,73; Н2 O –
17 1
2 16
0,2; 1Н2
О – 0,04;
Н Н О – 0,03; остальные пять изотопных разновидностей
присутствуют в воде в ничтожных количествах. Кроме стабильных изотопных разновидностей, в воде содержится небольшое количество радиоактивного 3Н2 (или Т2О). Изотопный состав природных вод разного происхождения варьиру- ется. Особенно непостоянно отношение 1Н/2Н в пресных водах – в среднем
6900, в морской воде – 5500, во льдах – 5500-9000.
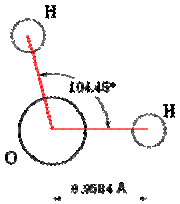
Строение молекулы и физические свойства. Атом водорода и кислоро- да в молекуле воды расположены в углах равнобедренного треугольника с дли- ной связи 0,0957 нм; валентный угол Н—О—Н 104,5°(рис.1; дипольный момент
6,17 • 10 -30 Кл • м; поляризуемость молекулы 1,45 • 10 -3 нм3; средний квадру- польный момент – 1,87 • 10-41 Кл-м2, энергия ионизации 12,6 эВ, сродство к протону 7,1 эВ. При взаимодействии молекулы воды с другими атомами, моле-
кулами и ионами, в т.ч. с другими молекулами воды в конденсируемых фазах,
 эти параметры изменяются.
Рис. 1. Строение молекулы воды
Химический состав воды. В водных растворах подавляющее большин- эти параметры изменяются.
Рис. 1. Строение молекулы воды
Химический состав воды. В водных растворах подавляющее большин-
ство солей существует в виде ионов. В природных водах преобладают три
аниона (гидрокарбонат HCO -, хлорид Cl- и сульфат SO 2- ) и четыре катиона (кальций Ca2+, магний Mg2+, натрий Na+ и калий K+) – их называют главны- ми ионами. Хлорид-ионы придают воде соленый вкус, сульфат-ионы, ионы кальция и магния – горький, гидрокарбонат-ионы безвкусны. Они составляют в пресных водах свыше 90-95\%, а в высокоминерализованных – свыше99 \% всех растворенных веществ. Обычно нижним пределом концентрации для главных ионов считают 1 мг/л, поэтому в ряде случаев, например для морских и некото- рых подземных вод, к главным компонентам можно отнести также Br-, B3+, Sr3+ и др. Отнесение ионов K+ к числу главных является спорным. В подземных и поверхностных водах эти ионы, как правило, занимают второстепенное поло- жение. Только в атмосферных осадках ионы K+ могут играть главную роль. Однако ионная форма главных компонентов свойственна в полной мере лишь маломинерализованным водам. При увеличении концентрации между ио- нами усиливается взаимодействие, направленное на ассоциацию, т. е. процесс, обратный диссоциации. При этом образуются ассоциированные ионные пары,
например MgHCO + , CaHCO3+. Под влиянием климатических и других условий химический состав при- родных вод изменяется и приобретает характерные черты, иногда специфиче- ские для различных видов природных вод (атмосферные осадки, реки, озера, подземные воды).
Классификация природных вод по химическому составу Соотношение указанных элементов определяет основные свойства вод – щелочность, соленость и жесткость (рис. 2). По анионам выделяют три типа воды: 1) гидрокарбонатные; 2) сульфат- ные; 3) хлоридные и ряд промежуточных – гидрокарбонатно-сульфатные, сульфатно-хлоридные, хлоридно-сульфатные, а также более сложного состава.
Ca(HCO3)2 Ma(HCO3)2 MgSO4 Щелочность Mg(HCO3)2 Жесткость CaSO4 Соленость CaCl2 Na(HCO3) MgSO4 MgCl2 CaCl2 Na2SO4 MgCl2 NaCl
Рис. 2. Сочетание различных элементов, обуславливающих свойства воды
Под классификацией природных вод по химическому составу понимают распределение химического состава природных вод на классы по определен- ным признакам, которое составляет систему. Основой для систематизации в существующих классификациях служат следующие признаки: минерализация воды, концентрация преобладающего компонента или их групп, соотношение между концентрациями разных ионов, наличие повышенных концентраций ка- ких-либо специфических компонентов газового (CO2, H2S, CH4 и др.) или мине- рального (F, Ra и др.) состава. В настоящее время универсальной классификации не существует. К наи- более известным и часто употребляемым относятся классификации природных вод Ч. Пальмера, С. А. Щукарева, О. А. Алекина. Химический состав воды изо- бражают в виде индекса, формулы, графика или диаграммы. По преобладающему аниону воды делятся на три класса: гидрокарбонат- ные, сульфатные и хлоридные. Воды каждого класса делятся, в свою очередь, по преобладающему катиону на три группы: кальциевую, магниевую и натрие- вую. Каждая группа подразделяется на 4 типа по соотношению содержащихся в воде ионов (в эквивалентах). При этом класс природных вод обозначается сим- - 2- - волом соответствующего аниона: С — НСО3, S — SO4 , Сl — Сl; группа: сим- волом катиона: К+, Na+, Са2+, Мg2+; тип – римской цифрой. Формула воды записывается следующим образом. К символу класса до- бавляется нижний индекс – значение минерализации (с точностью до 0,1 г/л), к символу группы – верхний индекс – значение общего катионного состава (с точностью до целых единиц вещества в ммоль/л), например: С1,2 Nа0,5 – гидро- карбонатно-натриевая вода с общей минерализацией 1,2 г/л и преобладающей концентрацией гидрокарбонатных ионов и ионов натрия. Или СсаІІ50,4 – это значит, что вода гидрокарбонатного класса, группы кальция, типа ІІ, с минера- лизацией 0,4 г/дм3 и жесткостью 5 ммоль/дм3 (мг-экв/л). В природных водах присутствуют также растворенные газы. В основном это газы, которые диффундируют в воды из атмосферы воздуха, такие как ки- слород, углекислый газ, азот. Но в то же время в подземных водах или водах нецентрализованных источников водоснабжения, в минеральных и термальных водах могут присутствовать сероводород, радиоактивный газ радон, а также инертные и другие газы. В табл. 1. представлены ионы, наиболее часто встречающиеся в природ- ных водах. Таблица 1 Ионы, наиболее часто встречающиеся в природных водах
Химические свойства воды Химически чистая вода в обычных условиях – жидкость без цвета, вкуса и запаха. При нормальном атмосферном давлении (1013 гПа или 760 мм.рт.ст.) температура замерзания принята равной 0°С, а кипения 100°С. Вода является слабым электролитом. При температуре 25°С примерно 1 на 5 • 109 молекул подвергается электролитической диссоциации по схеме Н2О↔Н++ОН-. Вода хорошо растворяет многие полярные и диссоциирующие на ионы вещества. Концентрация ионов Н+ и связанная с ней концентрация ионов ОН- − являются важными характеристиками водных растворов и отражают водород- ный показатель (рН), который представляет десятичный логарифм концентра- ции водных ионов (моль/л), взятый с обратным знаком. Величина рН обуслов- ливает кислотную или щелочную реакцию водной среды. Минерализация воды. Общая минерализация представляет собой сум-
марный количественный показатель содержания растворенных в воде ве- ществ. Этот параметр также называют содержанием растворимых твердых ве- ществ или общим солесодержанием, так как растворенные в воде вещества на- ходятся именно в виде солей. Минерализация выражается в мг/л или г/л. В по- давляющем большинстве случаев солевой состав природных вод определяется
катионами Са2+, Мg2+, Nа+, К+ и анионами НСO -, Сl- , SO 2- . Эти ионы называ- ются главными ионами воды или макрокомпонентами; они определяют хими- ческий тип воды. Остальные ионы присутствуют в значительно меньших коли- чествах и называются микрокомпонентами; они не определяют химический тип воды. Содержание растворенных в воде веществ, выраженное в г/кг или про- милле (одна тысячная доля, 1/10 процента обозначается дробью «0 делить на 00» (‰), называется соленостью воды. К числу наиболее распространенных от- носятся неорганические соли (в основном бикарбонаты, хлориды и сульфаты кальция, магния, калия и натрия) и небольшое количество органических ве- ществ, растворимых в воде. В литературных источниках можно встретить несколько классификаций природных вод по степени минерализации. Наиболее распространена следующая: Пресные – до 1г/л; Слабосолоноватые – 1–3 г/л; Солоноватые – 3–10 г/л; Соленые – 10–50 г/; Рассолы – более 50 г/л. Очень часто общую минерализацию воды путают с сухим остатком. Сухой остаток определяется путем выпаривания литра воды и взвешивания того, что осталось. В результате не учитываются более летучие органические соедине- ния, растворенные в воде. Это приводит к тому, что общая минерализация и су- хой остаток могут отличаться на небольшую величину – как, правило, не более 10\%. Уровень содержания солей в питьевой воде разный в разных геологиче- ских регионах (вследствие различной растворимости минералов). Кроме при- родных факторов, на общую минерализацию воды большое влияние оказывают промышленные сточные воды, городские ливневые стоки (особенно когда соль используется для борьбы с обледенением дорог) и т. п. В зависимости от минерализации природные воды можно разделить на следующие категории (табл. 2). Соленость воды – содержание в воде хлоридов и сульфатов Na, Mg, Ca. Таблица 2 Классификация вод по солености (по А. М. Овчинникову)
Природные воды представляют собой собственно воду – химическое со- единение кислорода и водорода – и растворенные в ней вещества, обусловли- вающие ее химический состав и свойства. В воде растворяются твердые, жид- кие и газообразные вещества, которые делятся на три группы: хорошо растворимые (в 100 г воды растворяется более 10 г вещества); плохо растворимые, или малорастворимые (в 100 г воды – менее 1 г вещества); практически не растворимые (в 100 г воды растворяется менее 0,01 г вещества). Минерализацией называют сумму содержащихся в воде минеральных веществ. Минерализацию пресных вод принято выражать в миллиграммах на литр (мг/л) или граммах на литр (г/л), соленых вод рассолов – в граммах на литр или процентах (\%). В зависимости от практического применения сущест- вует несколько видов классификации природных вод по степени минерализации. Агрегатное состояние воды и фазовые переходы Вода на Земле в зависимости от двух физических характеристик – темпе- ратуры и давления может находиться в трех агрегатных состояниях или фазах – твердом (лед), жидком (собственно вода) и газообразном (водяной пар). Изме-
нение агрегатного состояния воды называют фазовыми переходами (рис. 3).
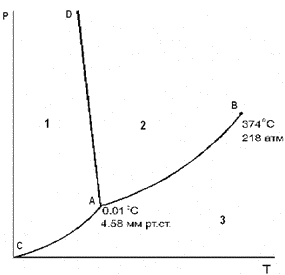
Рис. 3. Диаграмма стояния воды или фазовая диаграмма
В ней по оси абсцисс откладывается температура, а по оси ординат – дав- ление. Диаграмма представляет собой три кривые: Кривая АВ – кривая испарения – выражает зависимость давления пара жидкой воды от температуры (или, наоборот, представляет зависимость тем- пературы кипения воды от давления). Другими словами, эта линия отвечает двухфазному равновесию (жидкая вода) D (пар), и число степеней свободы, рассчитанное по правилу фаз, составляет С = 3 - 2 = 1. Такое равновесие назы- вают моновариантным. Это означает, что для полного описания системы дос- таточно определить только одну переменную – либо температуру, либо давле- ние, т.к. для данной температуры существует только одно равновесное давле- ние и для данного давления – только одна равновесная температура. При давлениях и температурах, соответствующих точкам ниже линии АВ, жидкость будет полностью испаряться, и эта область является областью пара. Для описания системы в данной однофазной области необходимы две незави- симые переменные (С = 3 - 1 = 2): температура и давление. При давлениях и температурах, соответствующих точкам выше линии АВ, пар полностью сконденсирован в жидкость (С = 2). Верхний предел кривой испарения AB находится в точке В, которая называется критической точкой (для воды 374o С и 218 атм). Выше этой температуры фазы жидкости и пара становятся неразличимыми (исчезает четкая межфазная граница жидкость/пар), поэтому Ф=1. Линия АС – эта кривая возгонки льда (иногда ее называют линией суб- лимации), отражающая зависимость давления водяного пара надо льдом от температуры. Эта линия соответствует моновариантному равновесию (лед) D (пар) (С=1). Выше линии АС лежит область льда, ниже - область пара. Линия АD – кривая плавления, выражает зависимость температуры плавления льда от давления и соответствует моновариантному равновесию (лед) D (жидкая вода). Для большинства веществ линия АD отклоняется от вер- тикали вправо, но поведение воды аномально: жидкая вода занимает меньший объем, чем лед. На основании принципа Ле Шателье можно предсказать, что повышение давления будет вызывать сдвиг равновесия в сторону образования жидкости, т. е. точка замерзания будет понижаться. Исследования, проведенные Бриджменом для определения хода кривой плавления льда при высоких давлениях, показали, что существует семь различ- ных кристаллических модификаций льда, каждая из которых, за исключением первой, плотнее воды. Таким образом, верхний предел линии AD – точка D, где в равновесии находятся лед I (обычный лед), лед III и жидкая вода. Эта точка находится при -220С и 2450 атм. Тройная точка воды (точка, отражающая равновесие трех фаз – жидко- сти, льда и пара) в отсутствие воздуха находится при 0,0100o С и 4,58 мм рт.ст. Число степеней свободы С=3-3=0 и такое равновесие называют нонвариантным. В присутствии воздуха три фазы находятся в равновесии при 1 атм и при 0o С. Понижение тройной точки на воздухе вызвано следующим причинами: 1. растворимостью воздуха в жидкой воде при 1 атм, что приводит к сни- жению тройной точки на 0,0024o С; 2. увеличением давления от 4,58 мм рт.ст. до 1 атм, которое снижает тройную точку еще на 0,0075o С. Удельная теплота фазовых переходов воды очень велика. В тройной точ- ке вода одновременно находится во всех трех агрегатных состояниях. Диаграмма состояния воды иллюстрирует две ее аномалии, оказывающие решающее влияние не только на поведение воды на Земле, но и природные ус- ловия планеты в целом. По сравнению с веществами, представляющими собой соединения водорода с элементами, находящимися в периодической таблице Менделеева, температура замерзания и кипения воды необычайно высока. Аномально высокие значения температуры замерзания и кипения предопреде- ляют возможность существования воды на планете как в твердом, так и жидком состоянии и служат определяющими условиями основных гидрологических и других природных процессов на Земле. Плотность воды. Плотность – одна из важнейших физических характе- ристик любого вещества. Она представляет собой массу однородного вещества, приходящуюся на единицу объема и измеряется в кг/м3. Плотность воды явля- ется функцией температуры, солености, давления, коллоидных взвесей. Вода – единственное вещество, у которого в твердом состоянии плот- ность меньше, чем в жидком. При нормальном давлении плотность жидкой во- ды в диапазоне от 0 до 4°С ведет себя аномально, увеличиваясь с возрастанием температуры от 999,87 до 1000 кг/м3. Поэтому при охлаждении от 4 до 0°С, т. е. непосредственно перед замерзанием, охлаждающаяся вода не опускается вниз, что сохраняет на глубинах в пресноводных водоемах положительную темпера- туру и предохраняет воду от замерзания, а водные организмы от гибели. При последующем увеличении температуры выше 4 °С плотность воды, как и у всех веществ, уменьшается. Плотность льда заметно меньше жидкой воды, что также аномально. При температуре меньшей 0°С с уменьшением температуры плотность падает и составляет 920 кг/м3 при температуре - 20°С. Это приводит к тому, что лед, как вещество более легкое, чем вода всплывает и экранизирует водную толщу, защищая ее от охлаждения. Влияние солености на плотность также очень велико. Плотность морской воды может достигать 1025- 1033 кг/м3. Морская вода при солености 35‰ и нормальном давлении имеет при 0 и 20°С плотность 1028,17 и 1024,78 кг/м3 соответственно. Температура замерзания воды при увеличении солености на каждые 10‰ уменьшается при- близительно на 0,54°С, поэтому вода замерзает при отрицательной температу- ре, составляющей, например, -1,9°С при солености 35‰.
Физические аномалии воды. Характерные значения температуры воды. Температура наибольшей плотности дистиллированной воды при нор- мальном давлении 1,01 •·105 Па обычно принимается равной 4°С, хотя точное ее значение 3,98°С. Нужно также иметь в виду, что дистиллированной воды в природе нет, а вода так называемых пресных озер и рек всегда немного минерализована. На- пример, концентрация солей воды оз. Байкал составляет 0,0697кг/м3. Поэтому для природных озер и искусственных водохранилищ температура наибольшей плотности воды всегда немного меньше 4°С. Значение коэффициента a для дистиллированной воды, по лабораторным данным, равно 0,0079 °С/Па. Температура кристаллизации (замерзания) дистиллированной воды при нормальном атмосферном давлении принимается равной 0°С и служит началь- ным значением температурной шкалы термометра Цельсия. Процесс замерзания пресной и соленой воды происходит скачком с выде- лением теплоты кристаллизации. Обратный процесс, т. е. таяние льда, происхо- дит с поглощением того же количества теплоты, но без скачка, постепенно. Переохлаждение воды в природе, т. е. понижение ее температуры замер- зания по отношению к 0°С, наблюдается очень часто. В речных условиях пере- охлаждение поверхностного слоя воды составляет даже порядка - 1°С. Переохлажденная на поверхности реки вода переносится в глубину тур- булентным течением и в благоприятных условиях образует внутриводный (шу- га) и донный лед. При этом степень переохлаждения глубинных вод значитель- но меньше, чем поверхностных. Переохлаждение наблюдается также в озерах и морях, где оно впервые и было обнаружено еще в XVIII в. в виде так называе- мого якорного льда на опущенных на дно якорях. В лабораторных условиях в капиллярных трубках дистиллированную во- ду удалось переохладить до температуры - 33°С. К важным особенностям изменения агрегатного состояния воды относят- ся большая затрата тепла на плавление, испарение, сублимацию и большое вы- деление тепла при обратных переходах, аномально низкая температура замер- зания и высокая температура кипения. Для воды характерны следующие физи- ческие аномалии и свойства: • высокая по сравнению с другими веществами температура плавления, поэтому вода на Земле может находиться в твердом состоянии (ледники, снег) и жидком (реки, озера, подземные воды); • плотность льда значительно меньше плотности воды, благодаря этому при замерзании водоема лед экранирует его от дальнейшего охлаждения (лед обладает небольшой теплоемкостью); • при увеличении температуры от 0 до 4°С плотность также увеличивает- ся, поэтому при охлаждении поверхностного слоя до 4°С опускание и переме- шивание слоев воды прекращается; • удельная теплота ледообразования (количество теплоты затрачиваемое при превращении единицы массы льда при температуре плавления и нормаль- ном атмосферном давлении в воду) очень велика, поэтому процесс ледообразо- вания идет замедленно; • удельная теплота парообразования (количество теплоты, необходимое для превращения единицы массы воды в пар) очень велика, поэтому процесс парообразования и идет замедленно. Тепловые характеристики воды. Удельная теплоемкость (количество теплоты, необходимое для нагревания единицы массы воды на один градус) очень велика, поэтому вода медленно нагревается и медленно охлаждается, тем самым регулирует тепловые процессы на Земле. Теплоемкость — это количество теплоты, поглощаемой телом при нагре- вании его на 1°С. Определяется она по формуле: C = dQ/dt или C = Q/Δt, где dQ – бесконечно малое количество теплоты, вызвавшее бесконечно малое повышение температуры dt; Δt = t2 - t1 – изменение температуры тела, происходящее в результате подвода к нему количества теплоты Q; t1 и t2 – тем- пература тела до и после подвода к нему теплоты. Характеристикой теплоемкости вещества принята удельная теплоемкость – отношение теплоемкости тела к его массе: c = C/m или c = Q/(m Δt). Удельная теплоемкость воды – это количество теплоты, необходимое для нагревания 1кг дистиллированной воды на 1°С в пределах 14,5 – 15,5 °С. Удельная теплоемкость воды слабо зависит от температуры, поэтому в практи- ческих расчетах ее значение может быть принято постоянным, равным 4,2 кДж/(кг·°С). Удельная теплоемкость воды уменьшается с повышением температуры. Этим свойством, а также довольно большим значением удельной теплоемкости, вода отличается от всех других веществ, кроме ртути. С увеличением минерализации воды теплоемкость ее уменьшается. Для морской воды при малой солености теплоемкость уменьшается примерно на 0,006кДж/(кг·°С) на 1‰. Переход воды из жидкого состояния в твердое (кристаллическое – лед) сопровождается выделением теплоты кристаллизации Qкр., а обратный ему про- цесс – таяние льда – поглощением теплоты плавления Qпл.. Эта способность вещества определяется удельной теплотой кристаллизации (плавления): Lкр. = Qкр./mили Lпл. = Qпл./m,
где m – масса затвердевающего (тающего) тела. Удельная теплота кристаллизации воды Lкр. – это количество теплоты, ко- торое выделяется при кристаллизации 1 кг воды при постоянной температуре. Для дистиллированной воды она равна 33,3·104 Дж/кг. Переход воды из жидкого состояния в газообразное (пар) сопровождается поглощением теплоты испарения Qи. Источником ее обычно служит внутрен- няя энергия самой жидкости, поэтому при испарении она охлаждается. Обрат- ный испарению процесс – конденсация пара – сопровождается выделением те- плоты Qк, равной теплоте испарения. Эта способность вещества определяется удельной теплотой испарения (конденсации):
Lи = Qи/m или Lк = Qк/m.
Итак, удельная теплота испарения воды – это количество теплоты, необ- ходимое, чтобы перевести 1 кг воды в парообразное состояние при постоянной температуре. Удельная теплота испарения воды зависит от температуры, при которой испаряется вода. Эта зависимость определяется следующей эмпириче- ской формулой:
Lи = (25 – 0,024tп) 105,
где 25·105 Дж/кг – удельная теплота испарения при температуре поверх- ности воды, равной 0°С; tп – температура поверхности испаряющейся воды. Температуропроводность – физический параметр вещества и, в частно- сти, воды, способствующий передаче теплоты таким образом, что температура в каждой точке стремится к соответствующему в данный момент установивше- муся состоянию. Характеристикой температуропроводности является коэффи- циент температуропроводности a = λ/(cρ), где λ – коэффициент теплопровод- ности. Коэффициент температуропроводности воды слабо зависит от темпера- туры: при температуре, равной 0 и 10°С, a соответственно равно 0,485·10-3 и 0,504·10-3 м2ч. Отмеченные выше тепловые показатели воды аномальны по сравнению с аналогичными характеристиками других веществ. Это обстоятельство обязано ее структуре, обусловленной водородными связями между молекулами, харак- теризующимися большей прочностью, чем межмолекулярные взаимодействия. Например, большая теплоемкость воды может быть объяснена только распадом ассоциированных молекул при нагревании. Так как распад этих молекул сопро- вождается поглощением энергии, то при нагревании воды теплота расходуется не только на повышение температуры, но и на распад ассоциированных молекул. Вязкость, поверхностное натяжение. Вязкость достаточно мала, поэто- му вода является очень текучим веществом, она способна переносить различ- ные объекты. Поверхностное натяжение воды достаточно велико, поэтому образуется мениск – капиллярные силы, благодаря которым растения способны брать воду из почвы. Вторым следствием является то, что водяные капли обладают боль- шой ударной силой, и являются одной из причин возникновения эрозии. Вязкость есть физическое свойство вещества (жидкости, газа, твердого тела) оказывать сопротивление перемещению одной его части относительно другой. Вязкость является одним из главных свойств воды. Различают объем- ную и тангенциальную вязкость. Под объемной вязкостью понимают способ- ность жидкости воспринимать растягивающие усилия. Этот вид вязкости воды проявляется, например, при распространении в ней звуковых и особенно ульт- развуковых волн. Тангенциальная вязкость характеризует способность жидко- сти оказывать сопротивление сдвигающим усилиям. Исследования показывают, что сопротивление жидкости растягивающим и сдвигающим усилиям проявляется лишь при различных скоростях движения одного слоя жидкости по другому, т. е. при возникновении угловых скоростей сдвига частиц. Со стороны слоя, движущегося быстрее, на слой, движущийся медленнее, действует ускоряющая сила. Наоборот, со стороны слоя, движуще- гося медленнее, на слой, движущийся быстрее, действует тормозящая, задер- живающая сила. Эти силы, носящие название сил внутреннего трения, направ- лены по касательной к поверхности слоев. Поверхностное натяжение воды возникает на поверхности соприкасания ее с воздухом, твердым телом или другой жидкостью. Оно обусловлено силами притяжения между молекулами. Внутри воды силы притяжения между молеку- лами взаимно компенсируются, а на молекулы, находящиеся вблизи поверхно- сти, действует нескомпенсированная результирующая сила, направленная внутрь от ее поверхности. Поверхностное натяжение стремится уменьшить по- верхность жидкости до минимума. Поэтому капли жидкости имеют сфериче- скую форму, а в невесомости – форму шариков (поверхность сферы является наименьшей из всех геометрических фигур равного со сферой объема). Смачивание. При соприкосновении твердого тела с водой смачивание наблюдается в том случае, когда взаимодействие между их молекулами сильнее взаимодействия между молекулами самой воды. В этом случае вода будет стремиться увеличить поверхность соприкосновения и растечется по твердому телу. Когда же взаимодействие между молекулами твердого тела и молекулами соприкасающейся с ним воды более слабое, чем между молекулами самой во- ды, вода будет стремиться сократить поверхность соприкосновения с твердым телом. По отношению к твердым телам вода обладает свойством полного и час- тичного смачивания и полного несмачивания. Явление смачивания имеет большое значение при изучении передвиже- ния влаги по капиллярам в почвогрунтах и в снеге. Поверхность смачивающей жидкости, находящейся в узких капиллярах, принимает вогнутую форму. Электрические свойства воды. Удельное электрическое сопротивление воды ρэ существенно зависит от температуры. Минерализация воды резко по- нижает ее удельное электрическое сопротивление. Так, у ладожской воды оно составляет 2,6·104 (Ом•м)-1, а у морской – порядка 4-6 (Ом •м)-1. По приведен- ным значениям удельного электрического сопротивления можем судить, что чистая вода является плохим проводником электричества. Электрическая про- водимость воды может служить показателем загрязнения, как части водоема так и его в целом. Вода является хорошим растворителем. Характеристикой жидкости как растворителя является дипольный момент. У воды он весьма высокий (6,13·10- 29 Кл·м), что обусловливает ее свойства хорошего растворителя веществ, моле- кулы которых тоже полярны. Однако для сравнения способности одних веществ растворять в себе другие более удобным, чем дипольный момент, оказалось поня- тие диэлектрической проницаемости. Диэлектрическая проницаемость ε показывает, во сколько раз напряжен- ность поля с данным веществом ниже, чем в вакууме. Диэлектрическая прони- цаемость воды при 20°С ε = 81. Способность воды растворять соли возрастает с повышением температу- ры и понижается с ее уменьшением. Этим обстоятельством объясняется выпа- дение солей из воды сильно минерализованных озер осенью и в зимний период. Классификация видов движения воды в водных объектах Благодаря малой вязкости вода подвижна и перемещается в сторону ук- лона поверхности. Водные потоки делятся исходя из типов движения воды на стационарные (если скорость течения не изменяется во времени, dv/dt = 0) и нестационарные (если скорость течения во времени величина переменная, dv/dt ≠ 0). Стацио- нарные водные потоки делятся на равномерные (если скорость вдоль потока ос- тается неизменной, dv/dх = 0) и неравномерные (если скорость движения вдоль потока изменяется, dv/dх ≠ 0). Существуют два гидродинамических режима движения воды: ламинар- ный и турбулентный. В ламинарном режиме частицы воды движутся по парал- лельным траекториям, скорость их движения невелика. Примером ламинарного движения могут служить подземные воды, ледники. В турбулентном режиме движение частиц воды имеет хаотический характер, с относительно большой скоростью. Таким режимом отличаются движения вод в океанах, морях, реках, озерах. Характер движения определяется скоростью движения, гидродинамиче- ский режим потока характеризуется числом Рейнольдса (Rе):
где h – глубина водоема; Rе = νh/v, ν – кинематический коэффициент вязкости, при температуре ≈15°С, ν = 1•10-6 м2/с; v – средняя скорость. Если Rе < 300, то поток является ламинарным, если Rе > 3000 – турбу- лентным, 300< Rе <3000 соответствует переходному гидродинамическому ре- жиму потока [13].
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1.3. водный баланс в гидрологии
Водный баланс – количественная характеристика всех форм прихода и расхода воды в атмосфере, на земном шаре и его отдельных участках. Водный баланс является количественным выражением круговорота воды на Земле. Рас- четом составляющих водного баланса широко пользуются в гидрологии и в ме- теорологии для изучения водного режима.
Водный баланс суши характеризуется основной зависимостью: количест- во атмосферных осадков, выпадающих на данной территории, равно сумме ис- парения, стока и накопления (или расхода) воды в верхнего слоях литосферы. Для всего земного шара за годичный период и для средних многолетних усло- вий его отдельных территорий последний член водного баланса равен нулю.
В водном балансе атмосферы над определенной частью земной поверхно-
сти расход воды на выпадение осадков равен сумме испарения с земной по-
верхности, поступления или выноса водяного пара в результате его горизон- тального переноса воздушными течениями и изменения количества воды в ат- мосфере (последний член обычно мал по сравнению с другими членами водно- го баланса). Водный баланс атмосферы существенно зависит от условий атмо- сферного влагооборота, в ходе которого водяной пар переносится из одних районов в другие. Хотя испарение с поверхности суши составляет около 2/3 от количества осадков на континентах, фактически большая часть осадков, выпа- дающих на суше, формируется из водяного пара, принесенного воздушными течениями с океанов. Это объясняется тем, что циркуляция атмосферы уносит с континентов на океаны значительную часть водяного пара, образованного ме- стным испарением. Разность между испарением и осадками на континентах,
равная разности между приходом и расходом водяного пара в атмосфере над континентами, одновременно равна величине речного стока с континентов в океаны.
Если рассматривать водный баланс для всей земной поверхности в целом, так же как и для всей атмосферы, то годовая сумма осадков равна величине ис- парения, которая соответствует, по современным данным, приблизительно
100 см/год.
Метод водного баланса основан на составлении универсального уравне-
ния водного баланса для данной территории, анализе его составляющих и опре-
делении неизвестных компонентов (или плохо поддающихся расчету) по из-
вестным.
Приходную часть уравнения составляют атмосферные осадки, поверхно- стный и подземный сток (как естественный, так и искусственный); расходная часть уравнения состоит из испарения поверхностного и подземного стока (как естественного, так и искусственного), а также из изменения количества воды в объекте. Данное уравнение верно для участка суши или любого водного объек- та для определенного интервала времени.
Количественным выражением водного баланса является уравнение вод- ного баланса, физической основой уравнения является закон сохранения веще- ства, энергетической основой – солнечная энергия и сила тяжести.
Для вывода уравнения водного баланса, являющегося частным случаем закона сохранения вещества, необходимо учитывать следующие параметры:
время (сутки, декада, месяц, сезон, год); объем (вместо массы в уравнении - со-
стояние вещества); единицы слоя.
Уравнение водного баланса для объема выглядит следующим образом
(все компоненты выражены в единицах объема):
X + Y + + W + = Z + W - + Y -±ΔU,
где X – атмосферные осадки; Y1 – поверхностный приток; Y2 – поверхностный отток; W1 – приток подземных вод; W2 – отток подземных вод; Z – испарение; ΔU – изменение количества воды в пределах контура (объема); + ΔU – накопление воды: ледники, снег, водоемы, грунтовые воды, прирост уровня воды в водоеме; - ΔU – опускание уровня водоема (грунтовых вод).
|
Date: 2015-09-26; view: 745; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |

 Ca(HCO3)2 CaSO4
Ca(HCO3)2 CaSO4