
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Будова атому. Радіоактивність
Ми знаємо, що всі речовини складаються з молекул, молекули – з атомів, атоми з ядра, до складу якого входять протони та нейтрони, та електронів. Протони, електрони та нейтрони разом називаються елементарними частинками. Протони та нейтрони складаються кожен з трьох кварків. Подальший подрібнений розгляд будови речовини нам невідомий на сьогоднішній день.
В ХІХ сторіччі на основі експериментів було зроблено висновок, що атом не є найменшою неподільною частинкою речовини, а має складну будову. Він повинен мати в своєму складі від’ємно заряджені електрони.
Наприкінці ХІХ сторіччя існувала модель атома Томпсона: атом розглядався як кулеподібна структура, що складалася з додатної субстанції, в якій розміщені негативно заряджені електрони. Схема атома була схожа на пудинг з родзинками, і саме під такою назвою модель фігурує в науковій літературі. Ця модель задовольняла умові нейтральності атома. Але вона не пояснювала закономірності будови Періодичної системи хімічних елементів Д. І. Менделєєва, відмінності хімічних властивостей речовин. Тому ця модель уточнювалася, шукалися інші більш точні моделі будови атому.
Існування планетарної моделі атому, наявність в атомі ядра біла встановлена Ернестом Резерфордом у 1911 році у знаменитому досліді бомбардування золотої фольги радіоактивними альфа – частинками.
У дослідах, проведених Гансом Гейгером, Ернестом Марсденом під керівництвом Ернеста Резерфорда, використовувалися альфа-частинки, що випускалися радіоактивною речовиною. Ця речовина була розташована в закритому свинцевому контейнері, і радіоактивні частинки могли виходити лише через тонку щілину, створюючи вузький потік. Цей потік альфа-частинок потрапляв на золоту дуже тонку фольгу, а після проходження фольги частинки могли потрапляти на екран, що був покритий спеціальним шаром речовини, що світилася під ударами альфа-частинок (мал. 1).
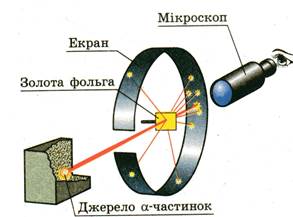
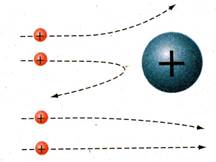
Мал. 1 Мал. 2
Потрапляння альфа-частинок на екран фіксувалося. Енергія радіоактивних частинок була досить великою. Вони практично без перешкод повинні були б проходити через фольгу.
В результаті експерименту побачили, що досить велика кількість альфа-частинок проходила крізь фольгу без викривлення траєкторії. Деяка їх кількість відхилялася на великі кути, при цьому це відхилення не можна було пояснити на основі моделі атома Томпсона. Але певна кількість альфа-частинок взагалі змінювали свій напрям руху практично на протилежний.
За результатами експериментів з’ясувалося нерівномірний розподіл радіоактивних частинок на екрані. За результатами експериментів було з’ясовано, що в центрі атома є щільна позитивно заряджена структура, що викривляє шлях альфа-частинок (мал. 2).
Резерфорд встановив, що в центрі атома міститься ядро з позитивними зарядом з малими розмірами в порівнянні з величиною атома золота. Атом має велику кількість порожнеч. Навколо ядра рухаються електрони та їх радіуси орбіт визначають розміри атому. Розміри ядра атому порядку 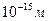 , а розміри орбіт електронів значно більші – порядку
, а розміри орбіт електронів значно більші – порядку 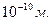
Про будову та склад атома ми можемо отримати багато інформації з таблиці Періодичної системи хімічних елементів Д. І. Менделєєва.
Розглянемо клітинку в таблиці.

Наприклад, срібло. В клітинці срібла (арґентум) є два числа 47 – порядковий номер елемента в системі та 107,8682 – відносна атомна маса елементу. Неціле число 107,8682 ми округлимо до 108 (неціле число пояснюється тим, що в природі зустрічаються декілька ізотопів срібла, і приведене в таблиці значення – середнє значення відносної атомної маси елемента).
Перше число (порядковий номер) в фізиці носить назву зарядове число.
Зарядове число (Z) характеризує кількість протонів в ядрі або кількість електронів на всіх орбіталях в нейтральному атомі елемента.
Отже, до складу ядра срібла входить 47 протонів і разом на всіх орбіталях атома рухаються 47 електронів. За масовим числом можна визначити загальний заряд ядра атома срібла: 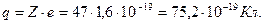 Такий же заряд, але від’ємного знаку, мають всі електрони в атомі.
Такий же заряд, але від’ємного знаку, мають всі електрони в атомі.
Друге число (відносна атомна маса елемента) має в фізиці назву масове число.
Масове число показує загальну кількість протонів та нейтронів в ядрі елементу.
Отже, до складу ядра срібла входять всього 108 частинок. Ми знаємо, що протонів 47, тоді нейтронів буде 108 – 47 = 61.
Як бачимо, що для будь – якого елементу за таблицею Періодичної системи ми можемо встановити кількість складових елементів (протонів, нейтронів та електронів), що складають нейтральний атом.
Для будь-якого елементу 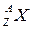 кількість протонів Np, нейтронів Nn та електронів Ne визначається:
кількість протонів Np, нейтронів Nn та електронів Ne визначається:
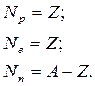
??? Визначте склад атомів наступних елементів:



Аргон Палладій Тантал
Date: 2015-09-05; view: 620; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |