
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Теория активных столкновений
Возьмем бимолекулярную газофазного реакцию:
А+В→С+D
Теория столкновений исходит из соображения, что бимолекулярная реакция может произойти только тогда, когда частицы реагентов А и В сталкиваются. Поэтому число элементарных актов реакции А + В → в единице объема пропорционально числу столкновений 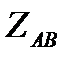 между частицами А и В в единицу времени. Из молекулярно-кинетической теории газов известно, что:
между частицами А и В в единицу времени. Из молекулярно-кинетической теории газов известно, что:
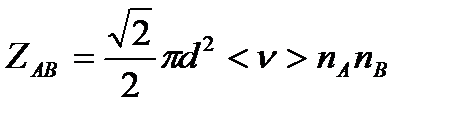 , где
, где
d- средний эффективный диаметр молекул;
<  >- среднеарифметическое значение скорости молекул;
>- среднеарифметическое значение скорости молекул;
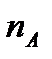 и
и 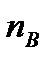 - число молекул А и В в единице объема.
- число молекул А и В в единице объема.
Чтобы при столкновении произошла реакция, необходимо, чтобы сталкивающиеся молекулы обладали некоторым запасом кинетической энергии 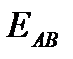 , необходимой для ослабления или разрыва связей в этих молекулах. Такие столкновения называются активными.
, необходимой для ослабления или разрыва связей в этих молекулах. Такие столкновения называются активными.
Если исходить из распределения Максвелла молекул по скоростям, доля активных столкновений в единицу времени от общего числа 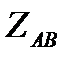 пропорциональна величине
пропорциональна величине 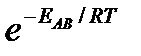
Отсюда следует, что число активных столкновений равно
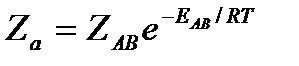 или
или 
Значение Z 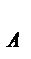 определяет скорость реакции, выраженную числом прореагировавших молекул А и В в единице объема за единицу времени.
определяет скорость реакции, выраженную числом прореагировавших молекул А и В в единице объема за единицу времени.
Выразив 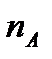 и
и 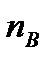 через молярные концентрации, а скорость в моль/см
через молярные концентрации, а скорость в моль/см 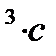 получим
получим

Сравнивая, это выражение для скорости со скоростью бимолекулярных реакций получим:
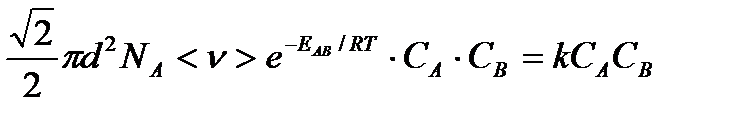
Отсюда находим, что
k = 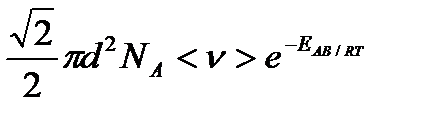
Если ввести обозначения для величин
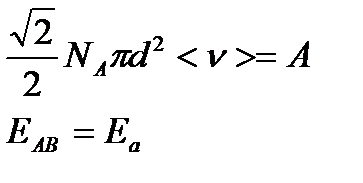
получим: 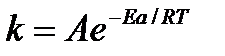
Множитель А в уравнении Аррениуса, согласно теории активных столкновений, равен числу столкновений в одном см 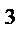 за 1с (выраженному в молях) при
за 1с (выраженному в молях) при 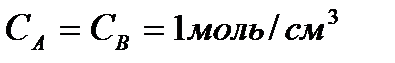
Проверка теории показала, что в отдельных реакциях вычисленные по опытным данным значения А хорошо согласуются с рассчитанными по уравнению:

Но для некоторых реакций значения А, найденные опытным путем, на несколько порядков меньше рассчитанных.
Имеются также реакции, для которых опытные значения А превышают теоретически рассчитанные.
Для объяснения расхождений теории с опытными данными было предложено ввести поправочный множитель, учитывающий ориентацию молекул в пространстве в момент столкновения по отношению друг к другу:
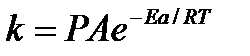
При благоприятной ориентации молекул Р=1, при неблагоприятной Р<1. Введение стерического множителя, качественно учитывающего геометрию столкновения молекул, не могло объяснить причину высоких значений А, т.е. Р не может быть больше единицы.
Date: 2015-09-17; view: 595; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |