
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Мониторинг водных объектов
При выборе места отбора пробы воды учитываются все обстоятельства, которые могут оказать влияние на состав взятой пробы. Различают две основные пробы: разовую и среднюю. Разовую пробу получают путем отбора требуемого объема воды за один раз. Средняя проба получается смешением равных объемов проб, отобранных через равные промежутки времени. Средняя проба тем точнее, чем меньше интервалы между отдельно взятыми составляющими ее пробами.
Воду на анализ отбирают в чистую посуду, предварительно 2-3 раза сполоснув ее исследуемой водой. С открытых водоемов пробы отбирают в фарватере реки с глубины 50 см. Бутыль с грузом опускают на глубину, после чего пробку открывают с помощью прикрепленного к ней держателя. Лучше для этой цели использовать специальные приборы - батометры, которые позволяют применять посуду разной формы и емкости. Батометр состоит из зажима, плотно обхватывающего посуду, и приспособления для открывания пробки на нужной глубине.
При длительном стоянии пробы могут произойти существенные изменения в составе воды, поэтому, если нельзя начать анализ воды сразу после отбора или через 12 часов после отбора, ее консервируют для стабилизации химического состава. Универсального консервирующего средства не существует.
Выделяют 3 группы показателей, определяющих качество воды:
А - показатели, характеризующие органолептические свойства;
Б - показатели, характеризующие химический состав воды;
В - показатели, характеризующие эпидемическую безопасность
воды.
Опыт 1. Определение показателей, характеризующих органолептические свойства воды
Органолептические свойства нормируются по интенсивности их восприятия человеком. Это запах, привкус, цветность, прозрачность, мутность, температура, примеси (пленка, водные организмы).
Температура
Определяется сразу после отбора пробы или непосредственно в водоеме термометром с ценой деления 0,1 С. Термометр держат в воде не менее 5 мин.
Прозрачность
Степень прозрачности выражается высотой столба жидкости (см), через который отчетливо виден специальный шрифт. Прозрачностью не менее 30 см должны обладать воды, подаваемые для питьевого водоснабжения без осветления. Речные воды, кроме горных могут иметь прозрачность 25 см. Уменьшение прозрачности природных вод свидетельствует об их загрязнении.
Оборудование, материалы
1) цилиндр с плоским дном; 2) шрифт, высота букв которого составляет 2 мм, а толщина линий букв – 0,5 мм; 3) линейка.
Материал: вода водоема.
Ход работы
Исследуемую воду наливают в цилиндр, под дно которого подкладывают на расстоянии 4 см шрифт. Сливают воду до тех пор, пока сверху через слой можно будет отчетливо прочесть этот шрифт. Высоту столба оставшейся воды измеряют линейкой. Определение производят при хорошем дневном рассеянном освещении на расстоянии 1 м от светонесущей стены.
Осадок
Взболтанную в бутылке воду наливают в цилиндр слоем примерно 30 см и оставляют в покое 1ч, если вода отобрана из открытого водоема, или на сутки, если вода взята из подземных источников. Осадок оценивают количественно (нет, незначительный, заметный, большой) и качественно (песчаный, глинистый, илистый, кристаллический, хлопьевидный). Отмечают также цвет осадка.
Большой осадок свидетельствует о загрязнении воды.
Цветность
Это природное свойство воды, обусловленное наличием гуминовых веществ, которые придают ей окраску от желтоватого до коричневого цвета. Гуминовые вещества образуются при разрушении органических соединений в почве, вымываются из нее и поступают в открытые водоемы. Поэтому цветность свойственна воде открытых водоемов и резко увеличивается в паводковый период. Цветность воды определяется в градусах. Вода, имеющая цветность 20º считается бесцветной. Вода, не подвергающаяся перед подачей потребителю обесцвечиванию, должна иметь цветность не выше 20º.
Оборудование, реактивы, материалы
1) фотоколориметр; 2) цилиндр на 100 мл; 3) мерные колбы на 1л; 4) дистиллированная вода; 5) стандартный раствор № 1: 0,0875 г бихромата калия, 2 г сульфата кобальта и 1 мл серной кислоты с пл. 1, 84 г/мл растворяют в дистиллированной воде и доводят объем до 1л. Раствор соответствует цветности 500º; 6) раствор № 2: 1мл конц. Н2SО4 доводят дистиллированной водой до 1 л.
Материал: вода водоема.
Для приготовления шкалы цветности смешивают растворы № 1 и № 2 в цилиндрах в следующих соотношениях.
Хромово-кобальтовая шкала цветности
| Раствор № 1, мл | |||||||||||
| Раствор № 2, мл | |||||||||||
| Градусы цветности |
Ход работы
Цветность можно определять визуально. Для этого в колориметрический цилиндр наливают 100 мл профильтрованной исследуемой воды и, просматривая окраску контрольных растворов сверху вниз, находят цилиндр, окраска жидкости в котором совпадает с окраской воды в цилиндре с исследуемой одой.
Цветность можно более точно определить на фотоколориметре. Для этого строят градуированный график по хромово-кобальтовой шкале цветности. Растворы с различной цветностью фотометрируют в кювете на 5см в синей части спектра относительно профильтрованной дистиллированной воды.
При цветности выше 35º водопотребление ограничивают.
Запах
Запах оценивается в баллах.
Водой, не имеющей запаха, считается такая, запах которой не превышает 2 балла.
Оборудование, материалы
1)колба с притертой пробкой, 2) коническая колба на 200 мл, 3) часовое стекло; 4) электрическая плитка, термометр.
Материал: вода водоема.
Ход работы
Колбу с притертой пробкой наполняют на 2/3 объема исследуемой водой, сильно встряхивают, открывают пробку и вдыхают ее запах. Для усиления интенсивности запахов воду подогревают. Коническую колбу на 200 мл наполняют на 1/2 ее объема исследуемой водой, закрывают часовым стеклом и нагревают до 60 ºС. Затем полбу вращательным движением взбалтывают и, сдвинув стекло, быстро определяют запах.
Интенсивность запаха определяют по 5-балльной шкале:
0 – не ощущается;
1 – обнаруживается только опытным исследователем;
2 – слабый, обнаруживается потребителем только в том случае, если указать на него;
3 – заметный, обнаруживается потребителем и вызывает его неодобрение;
4 – отчетливый, обращающий на себя внимание и делающий воду непригодной для питья;
5 – очень сильный, делающий воду совершено непригодной.
Естественный запах описывают, придерживаясь следующей терминологии.
| Символ | Характер запаха |
| А | Ароматный |
| Б | Болотный |
| Г | Гнилостный |
| Д | Древесный |
| З | Землистый |
| П | Плесневый |
| Р | Рыбный |
| С | Сероводородный |
| Т | Травянистый |
| Н | Неопределенный |
Чистые природные воды запахов не имеют.
Вкусы и привкусы
Определяются они в баллах. Без привкусов называется такая вода, привкусы которой не превышают 2 баллов.
Определение ведется с заведомо безопасной водой при 20ºС. Воду набирают в рот малыми порциями, не проглатывая. Отмечают наличие вкуса (соленый, горький, кислый, сладкий) или привкуса (щелочной, железистый, металлический, вяжущий и т.д.) и их интенсивность в баллах по шкале, аналогично определению интенсивности запаха.
При интенсивности запахов и привкусов выше 2 баллов ограничивается водопотребление, т.к. сильные запахи и привкусы могут быть показателями загрязнения воды загрязненными сточными водами или свидетельствуют о наличии биологически активных веществ, выделяемых сине-зелеными водорослями.
Результаты анализов заносятся в таблицу:
| Образец | Т-ра | прозрачность | осадок | цветность | запах |
Опыт 2. Определение активной реакции (рН)
Для определения рН воды применяются специальные реактивы – индикаторы, а также приборы – рН-метры со стеклянными электродами. С помощью универсальной индикаторной бумаги можно определить рН с точностью до 0,2-0,3 единиц рН. Измерение рН цветных растворов и суспензий индикаторным способом невозможно.
Электрометрический (потенциометрический) метод определения рН отличается большой точностью (до 0,02), позволяет проводить исследование практически в любой воде независимо от ее окраски, мутности, солевого состава.
Метод основан на измерении разности потенциалов, возникающих на границах между внешней поверхностью стеклянной мембраны электрода и исследуемым раствором, с одной стороны, и внутренней поверхностью мембраны и стандартным раствором – с другой. Внутренний стандартный раствор стеклянного электрода имеет постоянную концентрацию ионов водорода, поэтому потенциал на внутренней поверхности мембраны не меняется. Измеряемая разность потенциалов определяется потенциалом, возникающим на границе внешней поверхности электрода и исследуемого раствора. Изменение значения рН на единицу вызывает изменение потенциала электрода на 58,1 мВ при 20ºС. Пределы линейной зависимости потенциала электрода от рН обусловлены свойствами стеклянного электрода. Результат определения не зависит от окраски, мутности, взвеси, присутствия свободного хлора, окислителей или восстановителей, повышенного содержания солей. Влияние температуры компенсируется специальным устройством, вмонтированным в прибор.
Для измерения рН можно пользоваться потенциометрами (рН-метрами) различных марок. Стеклянные электроды этих приборов калибруются по буферным растворам.
Оборудование, реактивы, материалы
1)рН-метр, 2) эталонные растворы, 3) дистиллированная вода, 4) стаканчики на 200 мл – 4 шт., 5) фильтровальная бумага.
Материал: воды грунтовые, поверхностные и сточные.
Ход работы
Перед началом работы ознакомиться с инструкцией на прибор. Определить рН поверхностной, грунтовой и сточной воды в соответствии с инструкцией.
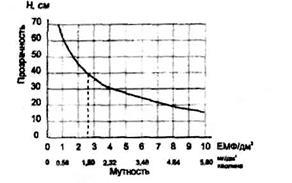
Опыт 3. Определение мутности и прозрачности воды с помощью тест-комплекта
Норматив мутности для питьевой воды -1,5 (2,0) мг/дм по каолину или 2,6 (3,5) (ЕМФ/дм по фармазину).
1. Метод определения
1.1. Метод определения прозрачности воды основан на визуальном измерении максимальной высоты водяного столба в трубке, сквозь который различим образец черного шрифта (высота 3,5 мм. ширина линии 0,35 мм) на белом фоне или юстировочная метка
1.2. Мутность (снижение прозрачности воды, вызываемое присутствием нерастворимых взвешенных веществ) определяется по градуировочному графику, исходя из измеренной величины прозрачности.
1.3. Используемый метод является унифицированным и соответствует ИСО 7027 и ГОСТ 3351.
2. Отбор проб и их подготовка к определению.
2.1 Стеклянную посуду, контактирующую с пробами, необходимо содержать в чистоте.
2.2 Пробы следует отбирать в стеклянные бутылки, закрывать пробками и проводить определение по возможности сразу же после отбора. Если хранение неизбежно, пробы следует хранить в прохладном темном помещении, но не дольше 24 ч, препятствовать контакту пробы с воздухом и избегать резкого изменения температуры. Проведению определения могут мешать вещества, окрашивающие воду, а также пузырьки воздуха.
3. Порядок применения тесткомплекта
1.Поместите юстировочную метку на горизонтальную поверхность. Установите трубку с экраном в вертикальном положении на метку Установите четкую видимость метки, приподнимая нижнюю часть экрана (около 1-2 см) и наблюдая сверху через открытое отверстие трубки.
2. Перемешайте тщательно пробу и залейте в трубку до уровня 60 см (300- 350 мл).
3. Понижайте уровень водяного столба, постепенно отбирая воду шприцом с соединительной трубкой до тех пор, пока не станет видимой метка.
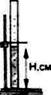 4. Определите по делениям на трубке максимальную высоту водяного столба, при которой различима метка.
4. Определите по делениям на трубке максимальную высоту водяного столба, при которой различима метка.
5. Полученные данные измерения высоты водного столба приведите с точностью до 1см.
Результаты анализа представьте в виде:
Прозрачность (Н)___________ см.
 |
Примечание. При прозрачности водяного столба менее 15см, пробу анализируемой воды разбавьте в 2-10 раз дистиллированной водой и повторите определение. Результат измерения разделите на коэффициент разбавления.
Пример. Измерили максимальную высоту водяного столба, сквозь который различима метка. Прозрачность Н = 40 см. Пользуясь градуировочным графиком, нашли соответствующее значение мутности - 1,50 мг/дм по каолину или 2.6 ЕМФ/дм3 по фармазину.
Результаты измерений заносятся в таблицу.
| №п/п | Исследуемая проба воды | Прозрачность, Н, см | Мутность, мг/дм по каолину | Мутность, ЕМФ/дм3 |
Опыт 4. Определение нитратов в воде
Проблема загрязнения продуктов питания нитратами (повышенное содержание нитратов в продуктах питания) актуальна для оценки качества овощей, фруктов, различных соков. Эта проблема возникла сравнительно недавно, в связи с развитием знаний о причинах онкологических заболеваний.
Загрязнение почв и поверхностных вод соединениями азота обусловлено бесконтрольным использованием азотных удобрений (в основном нитратов) в сельском хозяйстве. Говоря о нитратах, мы подразумеваем, в основном, растворимые соли азотной кислоты с катионами Nа+, K+, Са2+, Мg2+. Нитраты являются естественным компонентом почвенного раствора. Попадая в растения, они частично усваиваются и становятся естественным компонентом тканей организма. Нитраты являются легкорастворимыми солями (в 1л воды или почвенной влаги при 20°С может раствориться до 88г NaNО3 или 126 г Са(NО3) 2), и легко разносятся грунтовыми водами.
Нитратные удобрения (аммиачная, калийная и натриевая селитры) следует вносить в почву, строго соблюдая агротехнические рекомендации. В противном случае основная масса нитратов попадает в водоемы, вызывая их загрязнение и ускоренную эвтрофикацию. По этой причине внесение нитратных удобрений в почву, имеющее часто неконтролируемый характер, ученые называют намеренным загрязнением окружающей среды.
Существует несколько механизмов токсического воздействия нитратов на организм человека. Сами по себе нитраты относительно малотоксичны (относительно других распространенных токсикантов), в биологической среде в результате биохимических реакций они превращаются в нитриты, или соли азотистой кислоты {НNО2). Нитриты далее в желудочно-кишечном тракте человека (в кислой среде) взаимодействуют с соединениями, имеющими вторичные аминогруппы, и превращаются в N-нитрозоамины, которые являются канцерогенными соединениями, т.е. способствуют образованию злокачественных опухолей. Процесс образования N-нитрозоаминов можно приближенно описать следующей схемой: 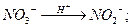
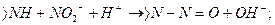
Нитриты токсичнее нитратов в 450 раз. Поступая в кровь, взаимодействуют с гемоглобином крови и блокируют его дыхательную функцию. При содержании в крови метгемоглобина 15-20% у человека возникает легкая слабость, головная боль, синюшность.
Таким образом, бороться надо не с нитратами, а с нарушениями агротехнических норм и правил, приводящих к загрязнению  окружающей среды и избыточному содержанию нитратов в продуктах. Кроме того, превращение нитратов в тканях овощей и фруктах протекает, как и любая химическая реакция, во времени. Поэтому для «самоочищения» овощей и фруктов от нитратов существенным является срок хранения. Так, зимой и особенно весной нитраты в количествах, превышающих ПДК, можно встретить лишь в свежей зелени.
окружающей среды и избыточному содержанию нитратов в продуктах. Кроме того, превращение нитратов в тканях овощей и фруктах протекает, как и любая химическая реакция, во времени. Поэтому для «самоочищения» овощей и фруктов от нитратов существенным является срок хранения. Так, зимой и особенно весной нитраты в количествах, превышающих ПДК, можно встретить лишь в свежей зелени.
Полезно привести следующие справочные данные: смертельная доза нитратов для человека составляет 8-15 г; допустимое суточное потребление - не более 5 мг на 1 кг веса человека. ПДК нитратов в воде водоемов - 45 мг/л; в почве -130 мг/кг (класс опасности 3). Данные о допустимом содержании нитратов в овощах и фруктах приведены в табл. 2.1.
Таблица 2.1
Предельно допустимые уровни содержания нитратов в продуктах растительного происхождения
(СанПиН 42-123-4619-88)
| № | Пищевой продукт | Содержание нитритов, мг/кг | ||
| из открытого грунта | из защищенного грунта | |||
| Арбузы | - | |||
| Виноград столовых сортов | - | |||
| Дыни | - | |||
| Зеленые культуры (салат, шпинат, щавель, капуста салатная, петрушка, сельдерей, кинза, укроп и др.) | ||||
| Кабачки | ||||
| Капуста белокочанная - ранняя (до 1 сентября) - поздняя | 900 500 | - | ||
| Картофель | - | |||
| Продолжение таблицы 2.1 | ||||
| № | Пищевой продукт | Содержание нитритов, мг/кг | ||
| из открытого грунта | из защищенного грунта | |||
| Морковь, - ранняя(до 1 сентября) - поздняя | - | |||
| Огурцы | ||||
| Перец сладкий | ||||
| Продукты детского питания (консервированные фруктовые соки и пюре) | - | |||
| Томаты | ||||
| Яблоки, груши | - | |||
ПДК нитратов в питьевой воде и воде поверхностных источников хозяйственно-питьевого назначения составляет 45 мг/л, в почве - 130 мг/кг почвы
1.Метод определения:
1.1 Метод определения нитрат-анионов основан на предварительном восстановлении нитрат-анионов до нитрит-анионов с последующим образованием азокрасителя в присутствии сульфаниловой кислоты и а-нафтиламина.
1.2 Определение нитрат-анионов в почве проводится путем извлечения их из почвы раствором хлорида калия и последующим анализом почвенной вытяжки указанным методом.
1.3 Концентрация нитрат-анионов в анализируемой пробе определяется методом визуального сравнения окраски пробы с контрольной плёночной шкалой образцов окраски. Содержание нитрат-анионов в почве и азота нитратов в почве определяется расчетным путем исходя из концентрации нитрат-анионов в почвенной вытяжке.
1.4 Точность выполнения анализа определяется:
1) точностью отбора пробы;
2)качеством реактивов, которое может ухудшиться при загрязнении, хранении в негерметично закрытых склянках, в теплом месте или на свету, а также при хранении растворов слишком продолжительное время (свыше гарантийного срока).
2. Выполнение анализа
1. Приготовление реактива на нитрат-анион
Приготовление реактива на нитрат-анион производится потребителем. Для этого отмерьте с помощью градуированных пробирок равные объемы растворов № 1 и № 2 и смешайте во флаконе для приготовления реактива на нитрат-анион. Реактив готовьте в количествах, необходимых для проведения анализа, и используйте в день приготовления.
2. Добавьте к содержимому пробирки 2,0 мл свежеприготовленного реактива на нитрат-анионы, закройте пробирку пробкой и встряхните для перемешивания раствора.
3. Добавьте к содержимому пробирки 2,0 мл свежеприготовленного реактива на нитрат-анионы, закройте пробирку пробкой и встряхните для перемешивания раствора
4. Прибавьте в пробирку 0,2г порошка восстановителя, используя шпатель (0,2г порошка заполняют 1/3 объема шпателя без горки). Закройте пробирку пробкой и тщательно перемешай
5.Оставьте пробирку на 5 минут для полного протекания реакции, периодически встряхивая содержимое пробирки.
6. Перелейте раствор из пробирки в склянку для колориметрирования до метки «10», стараясь не допустить попадания осадка в склянку
7. Проведите визуальное колориметрирование пробы. Для этого мерную склянку поместите на белое поле контрольной шкалы и, освещая склянку рассеянным белым светом достаточной интенсивности, определите ближайшее по окраске поле контрольной шкалы и соответствующее ему значение концентрации нитрат-анионов в воде в мг/л.
Примечание. Если в результате опыта окраска получается слишком интенсивная, то анализ повторите, при этом берите воду или фильтрат в объёме 3 или 2 мл, а полученный в итоге результат умножьте на 2 или на 3 соответственно.
- Заполните таблицу
| № п/п | Исследуемая проба воды или почвы | Концентрация нитратов в воде, мг/л | Концентрация нитратов в почве, мг/кг | ПДК нитратов в воде, мг/л и почве, мг/кг |
Опыт 5. Определение активного хлора в воде.
Активный хлор
Хлор может существовать в воде не только в составе хлоридов, но и в составе других соединений, обладающих сильными окислительными свойствами. К таким соединениям хлора относятся свободный хлор (С12), гипохлорит-анион {СlO), хлорноватистая кислота (НСlO), хлорамины (вещества, при растворении в воде которых образуются монохлорамин N Н2С1 дихлорамин NHС12, трихлорамин NС13). Суммарное содержание этих соединений называют термином «активный хлор». Содержащие активный хлор вещества подразделяют на две группы: сильные окислители - хлор, гипохлориты и хлорноватистая кислота - содержат так называемый «свободный активный хлор», и относительно слабые окислители - хлорамины - «связанный активный хлор». Благодаря сильным окислительным свойствам соединения, имеющие активный хлор, используются для обеззараживания (дезинфекции) питьевой воды и воды в бассейнах, а также для химической очистки некоторых сточных вод. Кроме того, некоторые содержащие активный хлор соединения (например, хлорная известь) широко используются для ликвидации очагов распространения инфекционных загрязнений.
Наиболее широко для дезинфекции питьевой воды используется свободный хлор, который при растворении в воде диспро-порционирует по реакции:
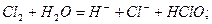
В природной воде содержание активного хлора не допускается; в питьевой воде его предельно допустимая концентрация (ПДК) установлена, в пересчете на хлор, на уровне (0,3-0,5) мг/л в свободном виде и на уровне (0,8-1,2) мг/л в связанном виде. Активный хлор в концентрациях на уровне ПДК присутствует в питьевой воде непродолжительное время - не более нескольких десятков минут, и нацело удаляется даже при кратковременном кипячении воды. По этой причине анализ отобранной пробы на содержание активного хлора следует проводить немедленно.
1. Метод определения
1.1. К соединениям, определяемым с помощью тест-
комплекта и называемым термином «активный хлор», относятся:
- растворенный элементарный хлор (С12);
- гипохлорит-анион (С1O);
- хлорноватистая кислота (Н С1O);
- неорганические хлорамины (монохлорамин NН2С1 дихлорамин NHС12, трихлорамин NС13)
- органические хлорамины - хлорированные производные соединений органического азота.
1.2. Метод определения активного хлора (йодометриче-
ский), основан на свойстве всех содержащих активный хлор
соединений в кислой среде выделять из йодида калия сво
бодный йод:
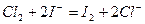
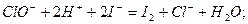
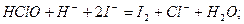

Свободный йод оттитровывают тиосульфатом натрия в присутствии крахмала. Реакцию проводят в кислой среде при рН 4,5, тогда определению не мешают нитриты, озон и другие соединения.
Веществами, мешающими определению, являются сильные окислители, которые выделяют йод из йодида калия -хроматы, хлораты и др. Концентрации, в которых указанные окислители оказывают мешающее действие, могут присутствовать в сточных водах, но маловероятны в питьевой и природной воде.
Метод может использоваться для анализа мутных и окрашенных вод.
Чувствительность метода - 0,3 мг/л при объеме пробы 250 мл и 0,5 мг/л при объеме пробы 50 мл.
1.3. Точность выполнения анализа определяется:
1)точностью отбора пробы;
2)качеством растворов и реактивов, которое может ухудшиться при загрязнении, хранении в негерметично закрытой склянке, в теплом месте или на свету, а также при хранении растворов свыше гарантийного срока;
3)погрешностью определения точки эквивалентности.
2 Выполнение анализа
2.1. Проведение анализа при концентрации активного хлора 0,5-2,0 мг/л
1.Налейте в коническую колбу 50 мл анализируемой воды до метки, либо с помощью мерного цилиндра. Колбу предварительно ополосните анализируемой водой.
2.Добавьте в колбу пипеткой-капельницей 1,0 мл ацетатного буферного раствора. Содержимое колбы перемешайте.
3.Добавьте в колбу около 0,1 г йодида калия, используя шпатель. Перемешайте содержимое колбы до растворения соли. При наличии активного хлора раствор приобретает желто-бурую окраску.
4. Наберите раствор тиосульфата в пипетку-капельницу и титруйте пробу по каплям. После добавления каждой капли анализируемый раствор перемешивайте покачиванием колбы до слабо желтой окраски раствора.
5. Добавьте пипеткой-капельницей 0,5 мл раствора крахмала (раствор в колбе синеет) и продолжайте титрование по каплям при перемешивании до полного обесцвечивания раствора.
Примечание. После изменения окраски пробу необходимо выдержать еще 0,5 мин для полного завершения реакции. В случае восстановления окраски необходимо добавить еще некоторое количество раствора тиосульфата.
6.Определите общее количество капель раствора тиосульфата, израсходованное на титрование (как до, так и после добавления раствора крахмала).
7.Вычислите концентрацию суммарного остаточного активного хлора (Сах) в мг/л по формуле:
Сах 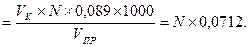
где: ЛУ- количество капель раствора тиосульфата натрия, израсходованного на титрование;
0,089 - содержание остаточного активного хлора, эквивалентное содержанию в 1 мл раствора тиосульфата натрия с концентрацией 0,0025 моль/л эквивалента; VК - объем капли, равный 0,04 мл;
VПР - объем пробы взятой для анализа, мл.
При необходимости анализ повторите для уточнения количества капель раствора тиосульфата, расходуемого на титрование.
2.2. Проведение анализа при концентрации активного хлора более 2,0 мг/л
При концентрации активного хлора более 2,0 мг/л титрование пробы проводят по объему с помощью градуированной пипетки и шприца.
1. Выполните операции 1-3 по п. 5.1.
2. Наберите раствор тиосульфата в градуированную пипетку и с помощью шприца титруйте пробу до слабо желтой окраски, добавляя раствор порциями, постепенно, после добавления каждой порции (капли) пробу перемешивайте покачиванием.
3. Добавьте пипеткой-капельницей 0,5 мл раствора крахмала (раствор в колбе синеет) и продолжайте титрование небольшими порциями или по каплям при перемешивании до полного обесцвечивания раствора.
Примечание. После изменения окраски пробу необходимо выдержать еще 0,5 мин для полного завершения реакции. В случае восстановления синей окраски, необходимо добавить еще некоторое количество раствора тиосульфата.
4.Определите общее количество раствора тиосульфата, израсходованное на титрование (как до, так и после добавления раствора крахмала).
5.Вычислите концентрацию суммарного остаточного активного хлора (Сах) в мг/л по формуле:
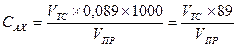
где: VTC - количество раствора тиосульфата натрия, израсходованного на титрование, мл;
0,089 - содержание остаточного активного хлора, эквивалентное содержанию в 1 мл раствора тиосульфата натрия с концентрацией 0,0025 моль/л эквивалента; VПР - объем пробы воды, взятой для анализа, мл. При необходимости анализ повторите для уточнения количества раствора тиосульфата, расходуемого на титрование.
6. Заполните таблицу.
| № п/п | Анализируемая проба воды | Концентрация активного хлора в воде, мг/л | ПДК хлора в воде, мг/л |
2.3. Проведение анализа при концентрации активного хлора 0,3-0,5 мг/л.
При концентрации активного хлора 0,3-0.5 мг/л на анализ отбирается проба воды объемом 250 мл в колбу для титрования (в состав комплекта не входит), определение проводится, как описано в п.2.2.
Контрольные вопросы
1. Какие соединения хлора присутствуют в воде?
2. Какие свойства этих соединений используются для обеззараживания воды?
3. Как с помощью тест-комплекта определяют содержание активного хлора в воде?
4. Назовите формулы, по которым можно рассчитать концентрацию активного хлора?
5. Проанализируйте результаты анализов.
Date: 2015-09-02; view: 638; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |