
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Дослiд 18.3. Властивостi пiридину
| Реактиви та матеріали: | пiридин, 0,1Н розчин хлориду залiза FeCl3, насиче-ний розчин пiкринової кислоти, карбонат натрiю (0,1Н розчин), перманганат калiю (0,1Н розчин), сода, червоний лакмусовий папірець |
| Обладнання: | мiкроскоп, предметне скло, пiнцет, пробiрки, паль-ник |
1. Розчиннiсть пiридину у водi. В пробiрку вносять краплю пiридину i 5 крапель води. Утворюється прозорий розчин. Пiридин добре розчиняється у водi.
2. Основний характер пiридину. За допомогою пiнцета смужку червоного лакмусового паперу вносять у пробiрку з розчином пiридину - папiр стає синiм.
Хiмiзм процесу:

Пiридин у водному розчинi утворює з водою основу, яка дисоцiює з утворенням гiдроксид iону. Константа iонiзацiї пiридину 2 . 10-9, i водний розчин його має лише слабку лужну реакцiю.
Основнi властивостi пiридину пояснюються присутнiстю неподiленої електронної пари у атома азоту:

Через пiдвищену електронну густину бiля атома азоту можна було б сподiватись сильних основних властивостей пiридину. Але пiридин дуже слабка основа. Це зумовлено поєднанням вiльної електронної пари азоту з p-електронною системою пiридину.
3. Осадження гiдрооксиду залiза Fе(ОН)3 розчином пiридину. У пробiрку вносять 2 краплi розчину пiридину i краплю розчину хлориду залiза. Випадають пластiвцi гiдроксиду залiза (III):
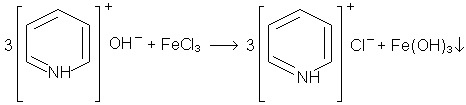
хлористоводнева
сіль піридину
Пiридин утворює солi з одним еквiвалентом кислоти. Вiн зв'язує соляну кислоту, яка утворюється при гiдролiзi хлориду залiза, i при цьому зрушує рiвновагу цiєi реакцiї до випадання гiдроксиду залiза.
4.Стiйкiсть пiридину до дiї окислювачiв. В пробiрку вносять краплю розчину пiри-дину, краплю розчину перманганату калiю i краплю розчину соди. Сумiш у пробiрцi ретельно перемiшують i нагрiвають у полум'ї пальника. Колiр перманганату калiю не змiнюється, бо пiридин стiйкий до дiї окислювачiв. Пiридин схожий з бензолом, при-чому пiридинове ядро бiльш стiйке до дiї окислювачів, нiж бензольне.
5. Стійкість піридину до дії окисників. У пробірку вміщують 1 краплю розчину перманганату калію й 1 краплю розчину соди. Вміст пробірки ретельно перемішують і нагрівають на полум¢ї пальника. Колір перманганату калію не змінюється, так як піридин стійкий до дії окисників. Піридин подібний з бензолом, причому піридинове ядро більш стійке до окиснення, ніж бензольне.
6.Утворення пікрату піридину. У пробірку вміщують 1 краплю водного розчину піридину й 4-5 крапель насиченого водного розчину пікринової кислоти. При перемішуванні вмісту пробірки випадають гарні голчасті кристали пікрату піридину, розчинні в надлишку піридину. Частину кристалів кладуть на предметне скло й розглядають під мікроскопом. Утворення пікрату підтверджує основні властивості піридину. Температура плавлення пікрату піридину 167°С.
Контрольнi запитання
1. Як можна розрiзнити бензол, анiлiн i пiридин?
2. Як можна роздiлити бензол i пiридин?
3. Напишiть будову сполук: 2,5-диметилфуран; a-бромтiофен; a, a'- диметилпiрол; 2-амiнопiридин; b-пiридинсульфокислота; 4-iндолкарбонова кислота.
4. Напишiть рiвняння реакцiй при пропусканнi над нагрiтим до 450 оС оксидом алюмiнiю (реакцiя Юр'єва) речовин: метиламiну з 1-метилфураном; тiофену з етиламiном; 1-метилпiролу з сiрководнем.
Додаток 1.
БУДОВА ТА НАЗВА ФУНКЦІОНАЛЬНИХ ГРУП ОРГАНІЧНИХ МОЛЕКУЛ
| Функціональна група | Органічні сполуки | ||
| Назва | Формула | Клас | Приклади формул |
| Гідроксил | - ОН | Спирти, феноли, вуглеводи | СН3 - ОН, С6Н5ОН, С6Н12О6 |
| Карбоніл або оксо- | 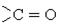
| Альдегіди, кетони, хінони, вуглеводи | 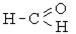 , , 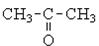 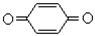 , С6Н12О6 , С6Н12О6
|
| Ефірна проста, оксидна | С - О - С | Прості ефіри спиртів, фенолів, епоксиди | СН3 - О - СН3, 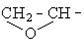 С6Н5 - О - СН3, С6Н5 - О - С6Н5
С6Н5 - О - СН3, С6Н5 - О - С6Н5
|
| Напіваце-тальна (глікозидна) |
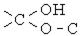
| Напівацеталі, вуглеводи (циклічні монози) | 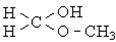 , , 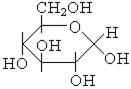
|
| Ацетальна | 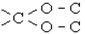
| Ацеталі, вуглеводи (оліго- та полі-) |  , ,
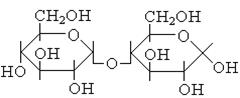
|
| Карбоксил | 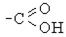
| Карбонові кислоти | 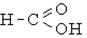 , С17Н35 - СООН , С17Н35 - СООН
|
| Ефірна складна (естерна) | 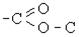
| Складні ефіри (естери), жири | 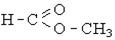 , , 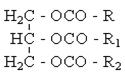
|
| Ангідридна (карбо-) | 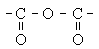
| Ангідриди карбонових кислот | 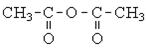
|
| Аміно- | - NH2 | Аміни | СН3 - NH2, C6H5 - NH2 |
| Іміно- | 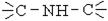 , ,
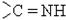
| Іміни, основи Шиффа | H3C – NH - CH3, 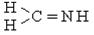
|
| Амідна | 
| Аміди кислот | 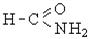
|
| Нітро | - NO2 | Нітросполуки | Н3С - NO2 |
| Нітрильна | - С º N | Нітрили, цианіди | CH3 - C º N |
| Сульфо- | - SO3H | Сульфокислоти | C6H5 - SO3H |
| Тіол (або меркапто-) | - SH | Тіоспирти, тіофеноли | CH3SH, C6H5 - SH |
| Галогени | F, Cl, Br, J | Галогенопохідні | С2Н5J, C6H5- Cl |
НАФТА, БЕНЗИН, ПОЛІМЕРИ Додаток 2.
| Фракції при перегонці нафти | Октанове число деяких С7- та С8- вуглеводнів | |||||||||||
| Фракції | Склад | Діапазон кипіння, °С | Примітка | Назва | Формула | Число | ||||||
| Газ Бензин "прямий" Гас, нафто-ве паливо Мастила Парафіни Озокерит Асфальт | С1 - С5 С5 - С12 С12 - С18 ³ С16 ³ С20 С20 - С30 С36 | від -160 до +30 від 30 до 200 від 180 до 400 ³ 350 Легкоплавкі Частковий екстракт з па-рафінових нафт В'язкі залишки | Газоподібне паливо, сиро-вина для одержання Н2 Моторне паливо Дизельне паливо, паливо для літаків, крекінг Мастильні матеріали Свічки, парафін для сірни-ків, медичний парафін Церезин, мастила, політура, медичні потреби Дорожне покриття, паливо | н-Гептан і-Гептан (2-метил-гексан) Метилциклогексан 2,3-Диметилпентан Ізооктан (2,2,4-Три-метилпентан) | 


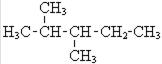 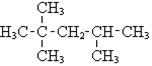
| |||||||
| Назви та скорочені структурні формули деяких алкільних груп | Основні крупнотонажні полімери та їх мономери | |||||||||||
| Назви | Формула | Назва | Формула | Назва | Формула | Назва | Ланка | Застосування | ||||
| Метил Етил н-Пропіл ізо-Пропіл (і-Пропіл) н-Бутил втор-Бутил ізо-Бутил (і-Бутил) | СН3-
СН3-СН2-
СН3-СН2-СН2-
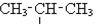 СН3-СН2-СН2-СН2-
СН3-СН2-СН2-СН2-

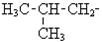
| трет-Бутил н-Аміл Неопентил Вініл Аліл Ізопропеніл |
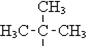 СН3-СН2-СН2-СН2-СН2-
СН3-СН2-СН2-СН2-СН2-
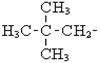 СН2=СН-
СН2=СН-СН2-
СН2=СН-
СН2=СН-СН2-
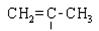
| Етилен Пропілен Тетра-фтор-етилен Вініл-хлорид Aкри- лонітрил Cтирол | CH2=CH2
 F2C=CF2
F2C=CF2
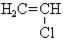

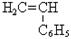
| Поліетилен Поліпропілен Тефлон ПВХ (полі-вінілхлорид) Поліакри-лонітрил Полістирол | -Н2С-СН2-
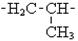 -CF2-CF2-
-CF2-CF2-
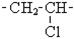 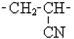
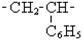
| Електроізоляція, пакетувальні вироби Ізолятори, підшипники, прилади харчової промисловості Лінолеум Килими штучні Кабелі телевізійні | ||||
Date: 2015-07-02; view: 694; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |