
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Эффекты колониестимулирующего фактора гранулоцитов-макрофагов добавок в культуральной среде на качество эмбрионов и исход беременности женщин в возрасте старше 35 лет
Абстрактные:
Цель: Цель данного исследования-изучить, является ли низкая
концентрация гранулоцит-макрофагального колонии-стимулирующего
фактора (ГМ-КСФ), добавляемого в питательную среду, выгодной
для бесплодных женщин в возрасте старше 35 лет.
Методы: Ретроспективное когортное исследование было выполнено для анализа качества эмбрионов и исхода беременности 212 контролируемых
циклов стимуляции яичников (COH) с или без добавления ГМ-КСФ (п=117 [ГМ-КСФ, 0,2 нг/мл] против п=95 [управления])
Результаты: Никаких существенных различий не наблюдалось в скорости деления (96.2 против 96.5 %), частоте формирования бластоцист (53.2 против
54.0 %), хорошей скорости деления бластоцисты (26.8 против 26.8 %), или доступна ставка эмбриона (54,2 против 49.7 %) между ГМ-КСФ группы и
контрольной группе. Однако, средний возраст ГМ-КСФ
группа (38.41±3.13 лет) был существенно 1 год старше
у соответствующей контрольной группы (37.45±2.74 лет)
(Р<0,05). ГМ-КСФ дополнение значительно уменьшило возникновение
биохимической беременности (55.6 % [контроль] против 20.8 % [GMCSF],
Р<0,05). Ни одного случая пороков развития новорожденных наблюдалось
в настоящем исследовании.
Вывод:Никакого положительного влияния GM-CSF на эмбрион отмечено не было,также добавление этого фактора значительно уменьшало возникновение химической беременности женщин в возрасте старше 35 лет, с указанием роли ГМ-КСФ в повышении компетентности имплантации эмбрионов, полученных от пожилыхбесплодных женщин.
Ключевые слова:Гранулоцитарно-макрофагальный колониестимулирующий,фактор (GM-CSF),Питательная среда,качество Эмбрион,исход беременности.
Введение:Несмотря на успехи в области экстракорпорального оплодотворения в культуральной среде значительно улучшена эффективность вспомогательных репродуктивных технологий в лечение бесплодия. Однако, выращивание эмбрионов in vitro и в естественных условиях сильно разнятся.Условия культивирования имеют важное значение для исхода вспомогательных репродуктивных технлогии и оказывают влияние на доимплантационное и послеимплантационное развитие и, возможно,на будущее здоровье потомства. В несоответствующих культурах эмбрион может развиваться неправильно и даже погибнуть, имплантация также будет невозможна.Чтобы обеспечить оптимальную среду для зиготы клинические эмбриологи уже давно занимаются оптимизацией условий культуры. Важным протоколом оптимизации является восполнение некоторые правил культивирования. Гранулоцит-макрофагальный колонии-стимулирующий фактор (GM-CSF) привлекает к себе большое внимание. GM-CSF, ГМ-КСФ экспрессируется в половых путях, в качестве агента программирования развития, он усиливает пролиферацию клеток,активирует развитие эмбриона, образования бластоцисты, и имплантации эмбриона. Тем более, некоторые существующие данные указывают на связь между ГМ-КСФ снижением уровня репродуктивной патологии у женщин, в том числе выкидыш, внутриутробной задержка роста плода, гестоза и преждевременных родов. Эти исследования доказывают, что ГМ-КСФ улучшает качество питательной среды. Однако большинство этих результатов исследований проводили на животных и влияние ГМ-КСФ на человеческие эмбриононы в преимплантационный и перинатальный периоды еще предстоит выяснить.Более того, настоящая концентрация GM-CSF (2 нг / мл),применяемая в человеческих исследования выбирается в основном из данных исследований на животных, которые не могут быть в точности равна человеческой яйцеклетке или эмбриону. Таким образом, нам все еще нужно больше знать о точной природе ГМ-КСФ для его рутинного применение в клинической практике лечения репродуктивной дисфункции. Данное ретроспективное когортное исследование было выполнено, чтобы выяснить, является ли низкая концентрация ГМ-КСФ (0,2 нг/мл), с добавлением в питательную среду, выгодной для развития эмбриона и последующей беременности бесплодных женщин в возрасте старше 35 лет. Мы надеемся, что данное исследование будет способствовать созданию новых идей для изменения качества существующей культурной среды.
Материалы и методы:
Учебные группы: Это исследование было одобрено исследовательской Этикой человека Комитет Пекина Чао-Янг-Больницы, все пациенты были проинформированы и получны их согласия. Были собраны сведения из 189 пациентов в возрасте старше 35 лет с 212 контролируемой овариальная гиперстимуляция (ЭКО) циклов в нашем центре от Мая 2013 года по сентябрь 2014 года.
Cтимуляция яичников:Перед началом ЭКО, пациенты были разделены на две группы: GM-CSF группы и контрольная группа, в зависимости от их собственного выбора. Гормональная стимуляция
было проведено по стандарту протоколаDecapeptyl, triptorelin acetate injection,Ferring, Switzerland, and recombinant human follitropin for injection, Merck Serono). Ответ яичников оценивалась по уровню эстрадиола в сыворотке и УЗИ мониторингу. Низкий уровень реакции был определен на основании Болонских критериев. Кратко, по крайней мере, два из следующих трех групп должы присутствовать:
1) старше 40 лет;
2) с плохим ответом яичников;
3)с аномальным тестом резерва яичников (антральный фолликул графа ≤5-7). Высокая реакция определялась концентрация сывороточного эстрадиола больше или равна 5000 ПГ/мл в день, инъекции хорионического гонадотропина (ХГЧ) и количеством ооцитов больше или равно 15. Инъекции ХГЧ (250 мкг) были введены, чтобы вызвать овуляцию, когда не менее трех фолликулов достигает диаметра 18 мм и больше на УЗИ.
Сбор и культура ооцитов:
Яйцеклетка подача была выполнена под контролем УЗИ на
37–38 ч после введения ХГЧ. Далее культивируют при атмосфере 6% О2 и 20 % О2.
Образцы спермы:
Образцы спермы были собраны сразу после забора ооцитов. Центрифугировали в градиенте плотности. Были использованы растворы для изоляции подвижных сперматозоидов (PureCeption, 40 и 80 %, шалфей, Америка). Оптимизация была достигнута по технике плавания вверх в течение 15-30 мин. В настоящем исследовании, оптимизированные сперматозоиды были взяты из свежего эякулята спермы.
Микроманипуляция:
После 2–4 часовой инкубации в среде при атмосфере 6 % СО2 и 20 % О2
были собранные кумулюс-ооциты, получавшие стандартное ЭКО или интрацитоплазматические инъекции сперматозоидов (ИКСИ). ЭКО было выполнено, когда количество подвижных спермотозоидов было >1 млн. после оптимизации. Каждый ооцит был оплодотворен 10,000 сперматозоидами в средах,содержащих масло (Vitrolife, Швеция) на
37 °С в атмосфере 6 % со2 и 20%О2. ИКСИ была проведена, когда подвижность сперматозоидов было ≤ 1 млн. после оптимизации.
Клетки вокруг ооцита были удалены с помощью гиалуронидазы (80 МЕ/мл,
Мудрец, Америка), и в каждый зрелый ооцит вкололи один зрелый сперматозоид,под стандартном увеличением в 20 мкл (Vitrolife, Швеция), с 7% (шалфей, Америка). Оплодотверенные яйцеклетки культуры вводили в G1 период (Vitrolife, Швеция) в микрокапли, покрытые масляным раствором в атмосфере 37° 6% СО2 и 20 % О2.
Эмбриокультуры:
Оплодотворение было проверено через 16–18 ч после инсеминации или 1 день после микроинъекции. Нормальные оплодотворенные (два
пронуклеусов и два полярных тельца) ооциты были немедленно перенесены в стандарт среднего (G1 стадии деления) при 37 °C в атмосфере 6 % со2 и 5%О2, дополнение 0,2 нг/мл ГМ-КСФ (рекомбинантный человеческий ГМ-КСФ,ORIGIO, Дания) исходя из собственного выбора пациентов перед началом ЭКО. На 3 день наблюдений (после 68 ± 1 ч осеменения) эмбрионы переносили в G2 стадию (этап бластоцисты,Vitrolife, Швеция) при 37 ° атмосфере 6% СО2и 5% O2.
Оценка эмбриона:
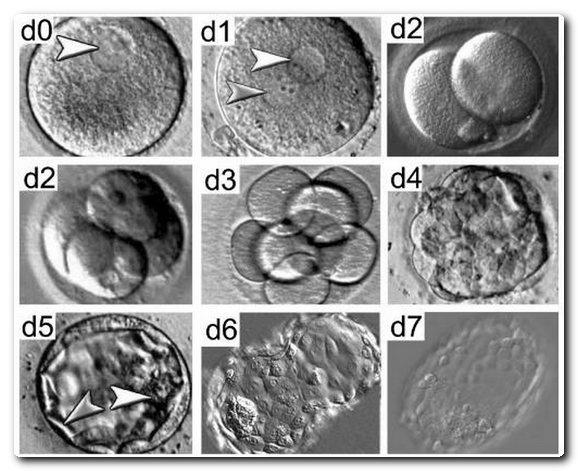
Оценка эмбрионова проводили в фиксированные моменты времени от 17, 44, 68, 116, и 140 ± 1 ч после осеменения двух профессионалов-клинических эмбриологов на основе наших предыдущих публикации и Стамбульского консенсуса и скоринговой системы Гарднер. В стадии дробления, оценки были следующие: Группа 1: эмбрионы с 8 - 10 бластомеров, деление и морфология обычные, фрагменты <5%, без вакуоли;
группа 2: эмбрионы больше шести бластомеров с небольшим неровным размером, фрагменты<20 %;
3 группа: бластомеры с неравным размером, фрагменты 20 - 50%;
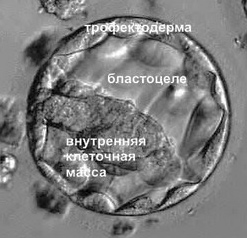
4 группа: > 50% фрагментов,явно отличается диаметр ячейки. В этой системе оценок, уровень развития эмбриона также был принят во внимание. Только с 8 эмбрионов - 10 бластомеров могут быть классифицированы как класс 1. Только эмбрионы с 8–10 бластомеров могут быть классифицированы как класс 1. За 6–7 или >10 клеток принимают 2 класс, и эмбрионы с количеством бластомеров менее 6 клеток может быть оценена как класс 3 или 4.Высокий уровень качества получили группы эмбрионов 1 и 2. На стадии бластоцисты, были получены следующие результаты: 1 этап: бластоцель менее половины объема эмбриона; 2-й этап: с бластоцель занимает по крайней мере половину объема зародыша; Этап 3: бластоцель полностью заполняет полость эмбриона; 4-й степени: бластоциста больше эмбриона; 5-го класса: образование трофобласта; 6 этап: полностью сформированная бластоциста. Бластоцисты после 2 этапа были классифицированы в соответствии с их внутренней клеточной массой и трофобласта. Для внутренней клеточной массы, класс А означает, плотно упакованные клетки массы со множеством ячеек; класс B-это свободно сгруппированные клетки со множеством ячеек; и класс C- внутри бластоцисты очень мало клеток. Трофобласт оценивают так:
Класс А- значит трофобласт с множеством ячеек, формирование сплоченного
эпителия; класс В- трофобласт с небольшим количеством клеток образуют рыхлый эпителий; класс С- трофобласт с очень маленьким количеством клеток. Этап 3 - 6 бластоцисты с внутренней клеточной массой и трофобластом оценивали как класс С, и были определены как хорошо качественные.
Перенос эмбрионов:
Оценка: Высококачественные эмбрионы были отобраны для переноса. Трансплантация эмбрионов обычно проводится на 3-й день. Если количество эмбрионов, пригодных для переноса, было меньше допустимого значения (≤3), перенос провели на 2 день. 10 пациентам трансплантацию эмбрионов сделали на 5-й день.
Рост: Сывороточные β-ХГЧ измеряли на 14-й день после переноса эмбриона. Беременность была зафиксирована на 7-8 неделе при ультразвуковом исследовании матки. Исход беременности учитывали у каждой пары.
Измерения результата: качество эмбрионов и исход беременности были зарегистрированы следующим образом: 1)скорость расщепления = число расщепленных эмбрионов / число оплодотворенных эмбрионов × 100%, 2)скорость образования бластоцисты = количество бластоцист /культивируемые эмбрионы с сформировавшейся бластоцистой × 100%, 3)хорошая скорость бластоцисты = число высококачественных бластоцист /образованные бластоцисты × 100%,
4)скорость имплантации эмбриона = количество трансплантируемых эмбрионов / общее количество эмбрионов,
5) частота наступления беременности = Число пациентов с клинической беременности /общее число пациентов,
6) частота имплантации = количество имплантированных эмбрионы /общее количество эмбрионов. Положительный ХГЧ-это значение сыворотки ХГЧ≥25 МЕ/мл на 14 день после трансплантации. Биохимически, беременность-означает положительный ХГЧ, но отсутствие плодного яйца на ультразвуке. Клиническая беременность- наличие внутриматочного плодного яйца на 7 - 8 неделе беременности при проведении УЗИ.
Статистический анализ: Данные были статистически проанализированы с помощью SPSS 18 и Хи- квадрат для выявления различий между 2 группами. Фишера тест был использован, когда N <40. P <0,05 рассматривалось как статистически значительное.
Результаты:
Общие клинические данные пациентов: В целом, средний возраст, стимуляция базального фолликула (Уровень ФСГ), антральный фолликул (АФК), Индекс Массы тела (ИМТ), и количество полученных ооцитов были: 38.03±3.02 лет, 8.53±4.03 МЕ/мл, 10.87±4.93, 22.98±3.18, 9.58±6.22, соответственно. Не было никаких существенных различий в ФСГ (8,35 ± 3,83 против 8,88 ± 4,19), АФК (11,11 ± 5,82 против 10,72 ± 4,16), индекс массы тела (23,27 ± 3,61 против 22,79 ± 2,81), число ооцитов (10,53 ± 7,45 против 8,99 ± 5,22), бесплодие типа (первичный или вторичный), причины бесплодия (женщины, мужчины или смешанный), длительность бесплодия (4,53 ± 3,69 лет против 4,88 ±4,62 лет), рак яичников ответы (низкий, нормальный или высокий), инъекционный гонадотропин (10,59 ± 2,04 дней против 10,33 ± 1,93 дней),дозировка гонадотропина (3007,26 ± 1154,56 МЕ против 2843,91± 1109.16 МЕ) между контрольной группой и ГМ-КСФ. Тем не менее, средний возраст и лечение по времени группы ГМ-КСФ были значительно выше, чем у контрольной группы (38,41 ± 3,13 лет против 37,45 ±2,74 лет; 1,61 ± 0,94 против 1,28 ± 0,72) (таблица1).

Воздействие ГМ-КСФ на эмбрион и потенциал его развития. Данные получены от пациенток в возрасте старше 35 лет:
Пациенты:
Пациенты с ЭКО -212 циклов (99 циклов ЭКО и 113 циклов ИКСИ) были разделены на две группы: рутинная и контрольной,последняя содержала 0,2 нг/мл ГМ-КСФ.
Параметры, отражающие качество эмбрионов: Проведено сравнение некоторых параметров, отражающих качество эмбрионов между этими двумя группами. Как показано в таблице 2, не было существенной разницы в скорости деления (96,5 против 96,2%), скорости образования бластоцисты (54,0 против 53,2%), хорошей скорости образования бластоцисты (26,8 против 26,8%) между контрольной группой и группой ГМ-КСФ.

Влияние осеменения образом на качество эмбрионов: Оплодотворение никаким образом не повлияло на скорость деления (96,3 против 95,9% [ЭКО]; 96,8 против 96,5% [ИКСИ]), скорость образования бластоцисты (56,9 против 50,8% [ЭКО]; 46,8 против 57,8% [ИКСИ]), или хорошая скорость образования бластоцисты (28,7 против 27,4% [ЭКО]; 22,1 против 25,6% [ИКСИ]) в каждой подгруппе. Более того, в отличие от группы ЭКО, доступная Ем БРСМ ставка (50,00 против 61,2%, п <0,05) от GM-CSF добавление группа была значительно выше, чем у соответствующая контрольная группа у больных ИКСИ.
Общие результаты: В целом, как показано в таблице 3, свежих ЭКО было выполнено на 117 пациентах, в том числе 67 циклов в обычной среде и 104 с добавлением ГМ-КСФ, соответственно. Не было никакого существенного различия в числе трансплантируемых эмбрионов (2.30±0.76 против 2.42±0.75), частоте наступления беременности (37.3 против 38.5 %), или частоте имплантации (26.6 против 23.4 %) между группой контроля и группы ГМ-КСФ. Однако, у ХГЧ-положительных женщин,с добавлением ГМ-КСФ значительно уменьшилось появление биохимической беременности (37.5 [контроль] против 18.4 % [ГМ-КСФ]). Хотя никаких статистических различий обнаружено не было, в процентах, скорость имплантации в группе ГМ-КСФ была выше (61.2 %) по сравнению с контрольной группой (52.5 %).Более того, подобные наблюдения были сделаны как в подгруппе ЭКО (57.7 % [контроль] против 68.2 % [ГМ-КСФ]) и ИКСИ подгруппы (42.9 % [контроль] против 55.6 % [ГМ-КСФ]). К сожалению, после того, как была установлена клиническая беременность на 7-8 недели, у 11 женщин случился выкидыш (2 из контрольной группы и 9 из ГМ-КСФ группы. Среди генетический анализ абортированных тканей был проведен 4 пациентам группы ГМ-КСФ. Хромосомные аномалии были выявлены в трех случаях.
2 день результатов: трансплантация был выполнена 96 пациентам (36 циклов контрольной группы, против 60- группы ГМ-КСФ). У этих больных не было никакого существенного различия (2.06±0.83 против 2.23±0.85), частота наступления беременности (22.2 против 31.7 %), или частота имплантации
(14.9 против 19.3 %) между группой контроля и группы ГМ-КСФ. Хотя по сравнению с контрольной группой, биохимическая частота наступления беременности значительно снизилась, после добавления ГМ-КСФ в культуральную среду (55.6 % [контроль] против 20.8 %
[ГМ-КСФ]), случаи потери беременности были зафиксированы в группе ГМ-КСФ.
3 день результатов: Трансплантация была проведена в 65 циклов (27 циклов контроля и 38 циклов ГМ-КСФ). Размер выборки ограничился, существенных различий обнаружено не было (2.81±0.39 [контроль] против 2.79±0.47 [ГМ-КСФ]), частота наступления беременности (59.3 % [контроль] против 52.6 % [ГМ-КСФ]), ставка имплантации (38.4 % [контроль] против 30.2 % [ГМ-КСФ]), биохимические показатели беременности (15.8 % [контроль] против 16.7 % [ГМ-КСФ]), скорость имплантации (68.4 % [контроль] против 70.8 % [ГМ-КСФ]).
5 день результатов: Также были 10 пациентов, принивших перенос эмбрионов на 5 день (4 цикла контрольных и 6 циклов GM-CSF). Значения были слишком малы для статистического анализа. Только 2 пациенты прогрессировали до полной беременности (1 из контрольной группы и 1 из группы GM-CSF).
Сравнение рождаемости и характеристик новорожденных в соответствии с добавлением GM-CSF: Рождаемость и характеристики новорожденных были исследованы в настоящем исследовании(таблица 4).

Никаких существенных различий не наблюдалось оценке детей из детских домов (17.9 против 21.1 %), плод накануне рождения (±37.17 1.90 неделе против 37.74±1.74 недели), вес при рождении (2819.17±626.28 G против 2925.14±547.25 г) между группой контроля и группой ГМ-КСФ. Те же самые результаты наблюдались при рождении одного ребенка и двойни. Дети «одиночки» имели следующие характеристики: гестационный возраст при рождении и вес при рождении были 37.83±2.32 недель (контроль) против 38.18±1.67 недель (ГМ-КСФ) и 3299.17±442.05 г (контроль) против 3217.00±448.10 г(ГМ-КСФ), соответственно. У близнецов, гестационный возраст рождения и вес при рождении были 36.50±1.22 недель (контроль) против 36.80±1.30 недель (ГМ-КСФ) и 2579.17±573.45 г (контроль) против 2496.00±355.03 г (ГМ-КСФ), соответственно. Ни одного случая пороков развития в данном исследовании не наблюдалось.
Обсуждение: Данное исследование привлекло внимание благодаря природным данным, тенденции к росту. Теперь, решение стоит ли дополнять ГМ-КСФ питательную среду в процедуре ЭКО у человека, остается за учеными. Настоящее исследование проводилось с целью оценить, может ли добавление ГМ-КСФ, как потенциальный фактор роста, быть выгодным для бесплодных пациенток в возрасте свыше 35 лет. К сожалению, по сравнению с контрольной группой, никаких существенных положительных влияний на эмбрион не наблюдалось. Настоящий результат отличался от нескольких предыдущих доклинических исследований, в которых наблюдалось, влияние снижения апоптоза ГМ-КСФ на человеческие эмбрионы. Эта разница может быть следующим. Во-первых, в исследованиях Sjöblom’s, до трансплантации эмбрионов, они прошли процедуру замораживания/оттаивания до введения ГМ-КСФ. Показано, что наблюдаемую пользу ГМ-КСФ было только видно в культуральной среде, содержащей низкую концентрацию сыворотки крови альбумина человека (2 мг/мл ЧСА), а не при использовании более высокой концентрации ЧСА (5 мг/мл), влияние ГМ-КСФ состоит в снижении стресса культуры. Таким образом, криоконсервация оказывает дополнительный стресс для эмбрионов и может быть поражающим фактором. Во-вторых, клиническая характеристика пациентов в этом исследовании не имеет места, по сравнению с предыдущими доклиническими исследованиями, не хватает доноров для достоверной клинической информации. В-третьих, компетентность эмбрионов, полученных от женщин старшего возраста (>35 лет), как правило, слабее, чем от молодых женщин, и низкая концентрация ГМ-КСФ (0,2 нг/мл) может быть недостаточной для улучшения качества эмбрионов. Различные исследования после проведения различных методов могут привести к разным результатам. Более тщательные исследования с использованием стандарта оценки показателей и конечных точек должны учитываться в будущих исследованиях.
Помимо его влияния на потенциал развития эмбриона, GM-CSF также влияет на исход беременности. Это значительно уменьшает частоту химической беременности (уменьшение раннего уровня абортов). Тем не менее, не было никакой разницы в Частота наступления беременности (37,3% [контроль] против 38,5% [GM-CSF]) или принимая ставки ребенка домой (17,9% [контроль] против 21,1% [GM- КСФ]) между этими двумя группами. Хотя статистически не сиг- щественны, ХГЧ был положительным в 47,1% в группе GM-CSF и в 59,7% в контрольной группе. Этот результат может несогласный можно объяснить тем, что средний возраст в Кор- управления ветствующие группы (37,45 ± 2,74 лет) был значительно 1 год моложе, чем у группы, GM-CSF (38,41 ± 3.13 лет) (п <0,05). Таким образом, это может быть предположение, что GM- CSF оказывает благотворное влияние на имплантации компетентности эмбрионы, полученные из пожилых женщин субфертильных. Несколько предыдущие клинические исследования также подтвердили положительную роль из GM-CSF в дополнение частота наступления беременности и / или скорости, родивших в пациенты, которые испытали по крайней мере один предыдущий выкидыша или неудачных циклов ЭКО [ 1, 20]. В настоящем исследовании, все бумаж- циентов набраны были в возрасте старше 35 лет, а вероятность добиться успешной беременности была значительно снижена по сравнению в нормальной популяции. Сравнивая полученные результаты с предыдущими исследования, мы могли бы заключить, вероятность того, что GM-CSF обладавшие embryotrophic свойства, особенно congenital- Ly дефицитных эмбрионов, полученных из пожилых женщин субфертильных. В отличие от предыдущих исследований [ 20] и благодаря extrane- ленные расходы на GM-CSF Кроме того, только относительно низкая концентрация GM-CSF (0,2 нг / мл) занятых в этом исследовании. Было подтверждено, что культура 2 нг / мл GM-CSF не беспокоить chromosom- аль конституции эмбрионов, по сравнению с кон- Троль [ 22]. Является ли относительно более низкой концентрации GM-CSF сказалось на эмбриональное хромосома может не может быть освещен в настоящем исследовании. давление лор исследования не выявили никакой разницы в гестационном возрасте, вес при рождении, соотношение полов, или возникновение аномалиями ции между GM-CSF группой и контрольной группой. Тем не менее, GM-CSF, как добавление было искусственное между- Конвенция, особенно в течение определенного периода восприимчивого чтобы эпигенетические изменения, последствия которых могут быть полу- дущих позже в жизни. Таким образом, эффективность и обеспечить при ти его потребности как дополнение ла RGE-масштабная оптимизация стендовые эксперименты и хорошо разработанные клинические исследования. Одним из ограничений данного исследования заключалась в следующем. GM-CSF, дополнение означало добавление расходов на пациента. Таким образом, его использование было основано на пациента ' s готовность платить. Из-за этого, клинические состояния между двумя группы не могут быть согласованы, и мы лишь ретроспективно проанализированы эффекты GM-CSF дополнение к качеству эмбрионов и исход беременности. Еще одно ограничение было связано с Оптимальная концентрация GM-CSF. Оптимальная концентрация из GM-CSF в среде в естественных условиях, содержащей Complex- ность различных факторов и всегда в динамическом метаболических баланс не может быть просто равна эффективной концентрационного ция GM-CSF в культуре в пробирке. К тому же, из-за Специфика человеческих образцов и этических проблем, это было труд- Культ выполнять непосредственно в пробирке эксперименты, чтобы исследовать есте- урал реакция предимплантационной эмбрионов на GM-CSF сти- таже. Для получения более точной информации, рандомизированное клини- скую исследования (РКИ) с большим населением от многопозиционные Было предложено, концентрируясь в частности последствий GM- CSF на эмбрионах разных стадий (2-й день, 3-й день, 5-й день); долгосрочное наблюдение с отпрысками также должны быть со- смотренных. И последнее, но не в последнюю очередь, в связи с снижение химической беременности (ранее число абортов, 37,5 против 18,4%), мы также наблюдали увеличение позже pregnancylossinday2transferpatients (5vs18% и 0 против 25%). Когда соотнесения риск хромосоме некоторые анеуплоидий с возрастом у женщин, только 4 из 11 пациенты, которые испытали потерю беременности принял хроматина mosomal анализ AB orted ткани. хромосома аномалии были обнаружены в трех случаях. Таким образом, в По нашему мнению, эти результаты также предложил благотворный CIAL эффекты GM-CSF на имплантацию эмбриона конкур- ствованием, а не уменьшая возникновение хромосоме некоторые отклонения. В настоящем исследовании мы не могли исключить возможность того, что-й е увеличение более позднего аборта может быть связано с уменьшением химического беременностей Cies. Таким образом, в будущем, мы рекомендуем полностью информированы согласие и предимплантационной генетического скрининга / предимплантационной генетической диагностики, если пациенты выбирают GM-CSF, добавки. Th erefore, есть еще много чтобы достичь до рутинного применения GM- CSF в АРТ.
Выводы:Хотя никакой выгоды GM-CSF на качество эмбрионов обнаружено не было служил, добавление GM-CSF значительно уменьшилось Возникновение химической беременности женщин в возрасте старше 35 лет, что указывает на роль GM-CSF в улучшении имплантация ставление компетентность врожденных эмбрионов дефицита. к достичь безопасного применения GM-CSF в клинической практике, мы рекомендовать дальнейшие строгие исследования, особенно в долгосрочной перспективе muticenter последующих исследований с единой део оценки дарты и сосредоточиться на здоровье потомства.
| <== предыдущая | | | следующая ==> |
| Для задач - http://www.bibliotekar.ru/deyatelnost-predpriyatiya-2/119.htm | | | На войне как на войне |
Date: 2016-05-25; view: 1042; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |