
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные положения молекулярно-кинетической теории
1. Все вещества состоят из мельчайших частиц - атомов и молекул.
2. Молекулы и атомы любого вещества находятся в непрерывном хаотическом движении, которое называется тепловым движением. При нагревании вещества интенсивность движения частиц увеличивается.
3. Молекулы вещества взаимодействуют между собой с силами притяжения F пр и отталкивания F от.
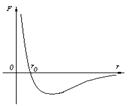
r = r 0 , F от = F пр,
r < r 0 , F от > F пр,
r > r 0 , F от < F пр,
r ® ¥, F ® 0.
Характер движения молекул зависит от агрегатного состояния вещества.
Движение молекул газов сводится к хаотическому поступательному движению.
Скорость молекул газов зависит от температуры.
4.8.
Термодинамические параметры - температура, плотность, давление, объем, удельное электрическое сопротивление и другие физические величины:
- однозначно определяющие термодинамическое состояние системы;
- не учитывающие молекулярное строение тел; и
- описывающие их макроскопическое строение.
На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа, которое выглядит так: 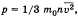 , где р — давление идеального газа, m0 — масса молекулы,
, где р — давление идеального газа, m0 — масса молекулы, 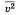 среднее значение концентрация молекул, квадрата скорости молекул.
среднее значение концентрация молекул, квадрата скорости молекул.
Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа 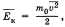 получим основное уравнение МКТ идеального газа в виде:
получим основное уравнение МКТ идеального газа в виде: 
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна 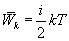 . Так как в одном киломоле содержится
. Так как в одном киломоле содержится 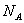 молекул, то внутренняя энергия одного киломоля газа будет
молекул, то внутренняя энергия одного киломоля газа будет 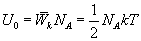
Учитывая, что 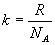 , получим
, получим 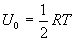
Для любой массы m газа, т.е. для любого числа киломолей 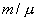 внутренняя энергия
внутренняя энергия
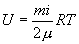
| (10.12) |
Из этого выражения следует, что внутренняя энергия является однозначной функцией состояния и, следовательно, при совершении системой любого процесса, в результате которого система возвращается в исходное состояние, полное изменение внутренней энергии равно нулю. Математически это записывается в виде тождества 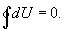
Второе начало термодинамики утверждает, что все необратимые процессы (а такими являются практически все тепловые процессы, во всяком случае, все естественно протекающие процессы) идут так, что энтропия участвующих в них тел возрастает, стремясь к максимальному значению. Максимальное значение энтропии достигается тогда, когда система приходит в равновесное состояние.
Вместе с тем выше уже отмечалось, что переход к равновесному состоянию является значительно более вероятным по сравнению со всеми другими переходами. Поэтому и наблюдаются только те изменения состояния, при которых система переходит из менее вероятного в более вероятное состояние (термодинамическая вероятность возрастает).
Связь между термодинамической вероятностью состояния системы и ее энтропией была установлена в 1875 г. двумя знаменитыми учеными – Д. Гиббсом и Л. Больцманом. Эта связь выражается формулой Больцмана, которая имеет вид:
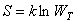 , ,
| (4.56) |
где 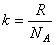 , R – универсальная газовая постоянная, NA – число Авогадро.
, R – универсальная газовая постоянная, NA – число Авогадро.
4.9.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнениеМенделеева — Клапейрона) — формула, устанавливающая зависимость междудавлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
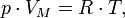
где
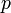 — давление,
— давление,
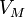 — молярный объём,
— молярный объём,
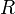 — универсальная газовая постоянная
— универсальная газовая постоянная
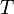 — абсолютная температура,К.
— абсолютная температура,К.
Так как 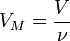 , где
, где 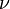 — количество вещества, а
— количество вещества, а 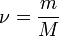 , где
, где 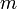 — масса,
— масса, 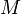 —молярная масса, уравнение состояния можно записать:
—молярная масса, уравнение состояния можно записать:
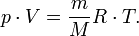
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
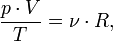
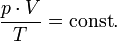
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
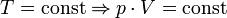 — закон Бойля — Мариотта (изотрмический процесс)
— закон Бойля — Мариотта (изотрмический процесс)
 — Закон Гей-Люссака (изобарический).
— Закон Гей-Люссака (изобарический).
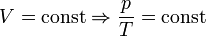 — закон Шарля (второй закон Гей-Люссака, 1808 г., изохорический)
— закон Шарля (второй закон Гей-Люссака, 1808 г., изохорический)
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величины в модели газа Ван-дер-Ваальса.
Для более точного описания поведения реальных газов при низких температурах была создана модель газа Ван-дер-Ваальса, учитывающая силы межмолекулярного взаимодействия. В этой модели внутренняя энергия  становится функцией не только температуры, но и объёма.
становится функцией не только температуры, но и объёма.
Date: 2015-05-18; view: 541; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |