
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энтропия. Цель урока: Показать статистический характер второго закона термодинамики и, основываясь на представлениях об энтропии
ЦЕЛЬ УРОКА: Показать статистический характер второго закона термодинамики и, основываясь на представлениях об энтропии, дать четвертую его формулировку.
 ТИП УРОКА׃ Лекция.
ТИП УРОКА׃ Лекция.
ОБОРУДОВАНИЕ:
ПЛАН УРОКА׃
1. Вступительная часть 1-2 мин
2. Лекция 35 мин
3. Ответы на вопросы 5 мин
4. Задание на дом 2-3 мин.
II. Формула на надгробии могилы Больцмана: S = К∙ lnW, где S - энтропия (степень беспорядка) системы, К - постоянная Больцмана, W - термодинамическая вероятность (сколькими способами можно произвести перестройки внутри системы, чтобы внешний наблюдатель не заметил их, то есть не изменились параметры системы).
Модель Вселенной, содержащей 64 атома (шахматная доска). Предположим, что во вселенной создалось такое распределение возбужденных атомов, как изображено на рисунке. Это соответствует тому, что в системе 1 запасено больше количество энергии в форме теплового движения, тогда как в системе 2 теплового движения вообще нет. Энтропия системы 1: S1 = k∙ ln W = k∙ ln1 = 0. Энтропия системы 2: S2 = 0. Такой сгусток энергии обладает идеальным качеством (нулевая энтропия).
Теперь вообразим некого демона - крохотное, бестелесное, озорное и вечно занятое существо, который занят непрерывной переделкой. Этот демон беспрестанно, и бесцельно переносит возбуждение с одного атома на другой; он символ "беззакония", царящего во Вселенной. Наступает момент, когда демон переносит возмущение с какого-либо атома системы 1 на какой-либо другой атом системы 2.
S1 = k∙ ln16 =? 16 способов размещения невозбужденного атома в системе 1,
S2 = k∙ ln48 =? не изменяющих ее термодинамические свойства.
Энтропия обеих систем возросла (второй больше чем первой), температура системы 2 увеличилась, а системы 1 уменьшилась. Демон переносит состояние возбуждения еще от одного атома системы 1 в систему 2:
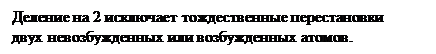
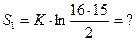

После переноса третьего:
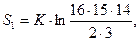
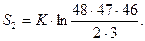
После переноса n - го:
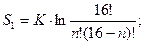
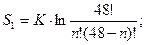
|
|

 Энтропия Вселенной S = S1 +S2
Энтропия Вселенной S = S1 +S2

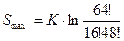 .
.
|
 Энтропия Вселенной достигает максимума при n = 12?! При этом средние энергии атома одинаковы в каждой системе. Определение температуры системы в этот момент:
Энтропия Вселенной достигает максимума при n = 12?! При этом средние энергии атома одинаковы в каждой системе. Определение температуры системы в этот момент: 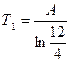 ;
; 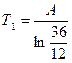 ; Т1 = Т2.
; Т1 = Т2.
Рассеяние энергии во вселенной приводит к увеличению энтропии. Энтропия вселенной достигает максимума в состоянии теплового равновесия. Равновесную температуру Вселенной
можно определить сразу 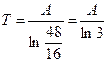 и легко предсказать естественное направление патока энергии.
и легко предсказать естественное направление патока энергии.
Почему же после достижения вселенной теплового равновесия в ней не происходит изменений (для макроскопического наблюдателя)? Разве демон прекратил свою деятельность? Нет! Он попал в им же расставленную сеть. Демон работает, но вероятность этого термодинамического состояния очень велика, поскольку реализуется максимальным и очень большим числом способов.
Вывод: Тепловое равновесие соответствует наиболее вероятному состоянию Вселенной!
Почему уменьшается высота подскоков мяча при его ударах о пол? Почему газ занимает весь предоставленный ему объем?
Если первоначально газ занимает 1/4 объема, то после распространения по всей Вселенной число размещений для одной частицы увеличивается в 4 раза, для двух ~ в 42, для 16 - в 416, а энтропия системы возрастает в последнем случае и станет S = k∙16 ln4.
Второй закон термодинамики: Все естественные процессы сопровождаются возрастанием энтропии Вселенной.
Любая замкнутая система стремится занять состояние с максимальной энтропией, поэтому события следуют один за другим, существует понятие причины и следствия, стрела времени направлена из прошлого в будущее.
"Повсюду вечность шевелится
И все к небытию стремится
Чтоб бытию причастным быть"
Гете
Date: 2015-05-09; view: 760; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |