
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Вывод уравнения Ван-дер-Ваальса
Как уже указывалось, для реальных газов необходимо учитывать размеры молекул и их взаимодействие друг с другом, поэтому модель идеального газа и уравнение состояния Клапейрона—Менделеева 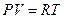 (для моля газа) для реальных газов непригодны.
(для моля газа) для реальных газов непригодны.
Учитывая собственный объем молекул и сил межмолекулярного взаимодействия, голландский физик И. Ван-дер-Ваальса (1837—1923) вывел уравнения состояния реального газа. Ван-дер-Ваальс для вывода использовал уравнение Клапейрона—Менделеева в которое ввел две поправки, учитывающие объем молекул и силы из взаимодействия.
1. Учет собственного объема молекул. Наличие сил отталкивания, которые противодействуют проникновению в занятый молекулой объем других молекул, сводится к тому, что фактический свободный объем, в котором могут двигаться молекулы реального газа, будет не 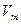 , a
, a 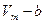 , где
, где 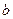 — объем, занимаемый самими молекулами. Объем
— объем, занимаемый самими молекулами. Объем 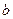 равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра
равен учетверенному собственному объему молекул. Если, например, в сосуде находятся две молекулы, то центр любой из них не может приблизиться к центру другой молекулы на расстояние, меньшее диаметра  молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса
молекулы. Это означает, что для центров обеих молекул оказывается недоступным сферический объем радиуса  , т. е. объем, равный восьми объемам молекулы, а в расчете на одну молекулу — учетверенный объем молекулы.
, т. е. объем, равный восьми объемам молекулы, а в расчете на одну молекулу — учетверенный объем молекулы.
2. Учет притяжения молекул. Действие сил притяжения газа приводит к появлению дополнительного давления на газ, называемого внутренним давлением. По вычислениям Ван-дер-Ваальса, внутреннее давление обратно пропорционально квадрату молярного объема, т. е.
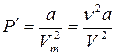 , (2.1)
, (2.1)
где 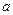 — постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения,
— постоянная Ван-дер-Ваальса, характеризующая силы межмолекулярного притяжения, 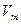 — молярный объем.
— молярный объем.
Вводя эти поправки, получим уравнение Ван-дер-Ваальса для моля газа (уравнение состояния реальных газов):
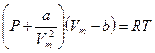 . (2.2)
. (2.2)
Для произвольного количества вещества 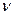 газа
газа 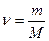 с учетом того, что
с учетом того, что 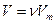 , уравнение Ван-дер-Ваальса примет вид
, уравнение Ван-дер-Ваальса примет вид
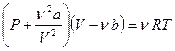 (2.3)
(2.3)
где поправки 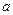 и
и 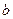 — постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
— постоянные для каждого газа величины, определяемые опытным путем (записываются уравнения Ван-дер-Ваальса для двух известных из опыта состояний газа и решаются относительно а и b).
При выводе уравнения Ван-дер-Ваальса сделан целый ряд упрощений, поэтому оно также весьма приближенное, хотя и лучше (особенно для несильно сжатых газов) согласуется с опытом, чем уравнение состояния идеального газа.
Ван-дер-Ваальса не единственное уравнение, описывающее реальные газы. Существуют и другие уравнения, некоторые из них даже точнее описывают реальные газы, но не рассматриваются из-за их сложности.
Date: 2015-05-09; view: 1899; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |