
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Типовые задачи
Задача №1: Определите заряд комплексного иона [ Cr+3 Cl3 (H2O) ]x.
x = 1·(+3) + 3·(-1) + 1·(0) = -2
Ответ: x = -2.
Задача №2: Назовите комплексное соединение Ca [ Pt+4 (NO2)4 (Cl)2 ].
Ответ: дихлоротетранитроплатинат (IV) кальция
Задача №3: Напишите формулу комплексного иона акватригидроксокупрат (II).
Ответ: [ Cu+2 (OH)3 (H2O) ]-
Задача №4: На осаждение ионов брома из раствора комплексной соли [Cr+3 (NH3)6 ] Br3 израсходовано 0,5 дм3 раствора AgNO3 с молярной концентрацией вещества в растворе С(AgNO3) = 0,2 моль·дм-3. Сколько граммов комплексной соли содержалось в растворе?
Дано: Решение:
 Vр-ра = 0,5 дм3 По закону эквивалентов:
Vр-ра = 0,5 дм3 По закону эквивалентов:
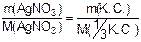 |
 С(AgNO3) = 0,2 моль·дм-3 n(AgNO3) = n(1/3 [Cr+3 (NH3)6 ] Br3)
С(AgNO3) = 0,2 моль·дм-3 n(AgNO3) = n(1/3 [Cr+3 (NH3)6 ] Br3)
m([Cr+3 (NH3)6 ] Br3) -? M(AgNO3) = 170 г·моль-1
М(1/3 [Cr+3 (NH3)6 ] Br3) = 397 / 3 = 132,3 г·моль-1
m(AgNO3) = C(AgNO3) · M(AgNO3) · Vр-ра
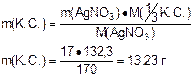 |
m(AgNO3) = 0,2 · 170 · 0,5 = 17 г
Ответ: m([Cr+3 (NH3)6 ] Br3) = 13,23 г.
Задача №5: Вычислить DG0 процесса:
[ Co(SCN)4]2- «Co2+ + 4 SCN-,
если Кнест = 5,5 · 10-3 при 250С.
Дано: Решение:
 Кнест = 5,5 · 10-3 По уравнению изотермы:
Кнест = 5,5 · 10-3 По уравнению изотермы:
Т = 298 К DG0 = - R · T · ln Kнест
R = 8,314 Дж·моль-1·К-1 DG0 = -8,314 · 298 · ln 5,5·10-3 = 12890,8 Дж·моль-1»
 » 12,89 кДж·моль-1
» 12,89 кДж·моль-1
DG0 -?
Ответ: DG0 = 12,89 кДж·моль-1.
IV. Решить задачи:
1. Определить заряд комплексного иона и назвать соединение:
[ Ti+4 (NO3)2 (H2O)4 ]x
2. Определить степень окисления комплексообразователя и назвать соединение: Na2 [ Cox (Cl)5 (NH3) ]
3. Константа нестойкости иона [Zn (OH)4 ]2- при 250С равна 7,08·10-16. Вычислить DG0 процесса вторичной диссоциации комплексного иона.
Ответ: DG0 = 86,43 кДж·моль-1
4. Какой объем раствора AgNO3 с молярной концентрацией эквивалента вещества в растворе 0,2 моль·дм-3 потребуется, чтобы при взаимодействии его с раствором калия гексацианоферрат (III) образовалось 5,36 г осадка комплексной соли?
Ответ: Vр-ра = 150 см3.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 191 - 203.
2. Ершов Ю.А., Кононов А. М., Пузаков С.А. и др. Практикум по общей химии. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для студентов мед. спец. вузов.-М.: Высшая школа, 1993. – С. 115 - 120.
3. Ленский А.С. Введение в бионеорганическую и биофизическую химию. – М., 1989. – С. 219 - 230.
4. Материалы лекций.
ЗАДАНИЕ №13
ПОТЕНЦИОМЕТРИЯ
I. Подготовить ответы на следующие вопросы:
1. Понятие о двойном электрическом слое (ДЭС). Механизм образования. Термодинамика ДЭС.
2. Уравнение Нернста, его анализ. Электродный потенциал. Стандартный электродный потенциал.
3. Стандартный водородный электрод, его устройство, электродная реакция, значение.
4. Гальванические цепи для определения стандартных электродных потенциалов.
5. Электроды сравнения. Хлорсеребряный электрод, его электродная реакция, электродный потенциал.
6. Электроды определения. Стеклянный электрод, его электродная реакция, электродный потенциал.
7. Ионселективные электроды и их применение в медико-биологических исследованиях.
8. Потенциометрический анализ. Потенциометрическое титрование, сущность метода, значение для биологии и медицины.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 464-488.
2. Материалы лекций.
ЗАДАНИЕ №14
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПОТЕНЦИАЛЫ. НАПРАВЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ ПРОЦЕССОВ.
I. Подготовить ответы на следующие вопросы:
1. Окислительно – восстановительные электроды, их классификация и значение для медицины. Роль инертного металла в них.
2. Уравнение Нернста – Петерса для простых и сложных систем, его анализ. Окислительно-восстановительные потенциалы.
3. Направление окислительно-восстановительных процессов.
II. Подготовиться к лабораторной работе «Измерение окислительно-восстановительных потенциалов».
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 464-485.
2. Материалы лекций.
ЗАДАНИЕ №15
КОНТРОЛЬНАЯ РАБОТА ПО ТЕМЕ: «ЭЛЕКТРОХИМИЯ»
I. Подготовиться к ответам на следующие вопросы:
1. Понятие о двойном электрическом слое (ДЭС). Термодинамика образования ДЭС.
2. Электродный потенциал. Уравнение Нэрнста, его анализ. Стандартный электродный потенциал.
3. Стандартный водородный электрод, его устройство, электродная реакция, применение.
4. Гальванические цепи для определения стандартных электродных потенциалов.
5. Электроды сравнения, их значение. Хлорсеребряный электрод, его электродная реакция, электродный потенциал х/с электрода.
6. Электроды определения. Стеклянный электрод, его электродная реакция. Электродный потенциал. Использование стеклянного электрода для измерения рН биологических жидкостей.
7. Ионселективные электроды, их значение для медицины.
8. Потенциометрический анализ. Потенциометрическое титрование, сущность метода, значение для медицины.
9. Окислительно-восстановительные электроды, их классификация, значение для медицины.
10. Уравнение Нернста-Петерса, его анализ.
11. Направление окислительно-восстановительных процессов.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. пособие для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 450-488.
2. Материалы лекций.
ЗАДАНИЕ №16
КОЛЛОИДНЫЕ РАСТВОРЫ
I. Подготовить ответы по следующим вопросам:
1. Определение коллоидных растворов. Сущность понятий «дисперсная фаза» и «дисперсная среда».
2. Классификация коллоидных систем на золи и гели, лиофобные и лиофильные.
3. Общие и специфические свойства коллоидных растворов в сравнении с истинными растворами.
4. Молекулярно-кинетические свойства коллоидных систем.
5. Оптические свойства коллоидных систем.
6. Электрокинетические явления. Электрофорез и электроосмос и их значение для медицины.
7. Двойной электрический слой коллоидных систем. Способы образования двойного электрического слоя.
8. Мицелла и ее строение.
9. Электрокинетический или дзета-потенциал и его свойства. Зависимость агрегативной устойчивости мицеллы от величины дзета-потенциала и концентрации электролита. Изоэлектрические состояние мицеллы.
10. Устойчивость и коагуляция коллоидных систем. Правила электролитной коагуляции.
II. Написать формулы мицелл: AgBr в KBr; BaCO3 в (NH4)2CO3; CaCO3 в CaCL2; Cu2[Fe(CN)6] в K4[Fe(CN)6], указать их строение.
ЛИТЕРАТУРА:
1. Ершов Ю.А., Попков В.А., Берлянд А.С. и др. Общая химия. Биофизическая химия. Химия биогенных элементов: Учеб. для мед. спец. вузов. - М.: Высшая школа, 1993. – С. 491-518.
2. Материалы лекций.
Date: 2015-09-24; view: 2688; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |