
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Групповой реагент, общие и фармакопейные реакции катионов IV аналитической группы.
БИЛЕТ №22
1.Реакция при температуре 60°С протекает за 1 мин.30сек. За сколько времени закончится эта реакция при температуре 80°С, если в данном интервале температурный коэффициент (у) равен 3?
Решение: в соответствии с правилом Вант-Гоффа при увеличении температуры от 60°С до 80°С скорость реакции возрастает:
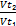 =
= 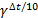 ,
,  = 32=9
= 32=9
Увеличивается в 9 раз.
2) скорость реакции обратно пропорциональна времени реакции. Следовательно:
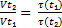 , или τ(t₂)= τ(t₁)*
, или τ(t₂)= τ(t₁)* 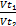
Где τ(t₁) и τ(t₂) – время реакции при температурах t1 и t2. Учитывая, что τ(t₁)= 90 сек. (1мин. 30 сек.), определяем время реакции при температуре t2: τ(t₁)= 90 сек* 1/9=
10 сек.
2.Напишите характерные реакции на ион NO2-.
Реакция с сильными кислотами (фармакопейная). Нитрит-ион под действием разбавленных сильных кислот (HCl, H2SO4) вначале переходит в
неустойчивую азотистую кислоту HNO2, которая затем разлагается с выделениемтоксидов азота (газообразные продукты желто-бурого цвета).
NO2- + H+ HNO2
2HNO2 N2O3 + H2O NO↑ + NO2↑ + H2O
Реакция с дифениламином (фармакопейная). Нитрит-ион при реакции с
дифениламином NH(C6H5)2 в среде концентрированной серной кислоты переводит (как и другие окислители) данный органический реагент в продукт
его окисления – синий дифенилдифенохинондиимин (“дифенилбензидиновый фиолетовый” или “голохиноид”). Нитрат-ион дает аналогичную реакцию с дифениламином.
Реакция с иодидом калия (нитрит-ион – окислитель). Нитрит-ион в
кислой среде окисляет иодид-ионы до свободного иода:
2NO2- + 2I-+ 4H+ I2 + 2NO ↑ + 2H2O
Нитрат-ионы NO3- не мешают проведению реакции, поэтому ионы
NO2- можно открыть с помощью рассматриваемой реакции в присутствии
нитрат-ионов.
Групповой реагент, общие и фармакопейные реакции катионов IV аналитической группы.
Групповым реагентом является водный раствор гидроксида натрия NaOH (или калия KOH)
Реакция катиона хрома (III) Cr3+
1. Гидроксиды щелочных металлом NаOH и KOH являются групповыми реактивами для четвертой группы. Гидроксид натрия из раствора соли хрома (III) выделяет серо-зеленый амфорный осадок гидроксида хрома (III):
CrCl3 + 3KOH = Cr(OH)3↓ + 3KCl
Cr3+ + 3OH- = Cr(OH)3↓
Осадок Cr(OH)3 растворяется:
а) в разбавленных кислотах Cr(OH)3↓ + HCl = CrCl3 + 3H2O
б) в избытке растворов щелочей Cr(OH)3↓ + 3NaOH = Na3[Cr(OH)6],
что указывает на амфотерность гидроксида хрома (III).
Сульфид аммония ((NH4)2S выделяет из растворов солей хрома (III) аморфный осадок гидроксида хрома (III):
2CrCl3 + 3(NH4)2S + 6H2O = 2Cr(OH)3↓ + 3H2S↑ + 6NH4Cl
Пероксид водорода Н2О2 в присутствии щелочи окисляет ион хрома Cr3+ в хромат ион CrO42-. Реакция сопровождается характерным внешним признаком – изменением окраски раствора из ярко-зеленой (цвет ионов Cr3+) в ярко-желтую (цвет ионов CrO42-).
Реакции протекают в такой последовательноти:
1. образуется гидроксид хрома CrCl3 + 3NaOH = Cr(OH)3↓ + 3NaCl
2. в избытке щелочи образуется комплексная соль
Cr(OH)3↓ + 3NaOH = Na3[Cr(OH)6]
3. окисление до хромата (желтого цвета)
Суммарная реакция:
2CrCl3 + 3H2O2 + 10 NaOH = 2Na2CrO4 + 6NaCl + 8 H2)
Если полученный раствор хромата подкислить разбавленной H2SO4, то пероксид водорода образует хромат в надхромовую кислоту H2CrO6 синего цвета, легко переходящую в органический слой.
Реакция катиона Zn2+
1. Гидроксиды щелочных металлов NaOH и KOH как групповой реактив выделяют из растворов солей цинка белый студенистый осадок гидроксида цинка:
ZnCl2 + 2NaOH = Zn(OH)2↓ + 2 NaCl
Zn2+ + 2OH = Zn(OH)2↓
2. Гидроксид цинка обладает амфотерными свойствами и поэтому растворяется:
а) в разбавленных кислотах Zn(OH)2 + 2HCl = ZnCl2 + H2O
б) в избытке щелочи Zn(OH)2 + 2NaOH = Na[Zn(OH)4]
Сульфид аммония (NH4)2S осаждает из нейтральных растворов ион цинка в виде белого аморфного сульфида цинка:
ZnCl2 + (NH4)2S = ZnS↓ + 2NaCl
Zn2+ + S2- = ZnS↓
Гексацианоферрат (III) калия K3[Fe(CN)6] красная кровяная соль) с солями цинка дает коричневато-желтый осадок гексацианоферрата (III) цинка:
3ZnCl2 + 2 K3[Fe(CN)6] =Zn3K3[Fe(CN)6]2↓ + 6KCl
3Zn3+ + 2[Fe(CN)6]2↓
Осадок растворяется в хлороводородной кислоте и растворе аммиака.
Реакция сухим путем (образование зелени Ринмана).
Кусочек фильтровальной бумаги, смоченный раствором соли цинка и раствором нитрата кобальта (II), при сжигании дает золу, окрашенную в зеленый цвет цинкатом кобальта (зелень Ринмана). При этом происходит реакция:
Zn(NO3)2 + Co(NO3)2 = CoZnO2 + 4NO2↑ + O2↑
проведению реакции мешают ионы Al3-+3, Cr+3.
Реакция катиона Al3+
1. Гидроксиды щелочных металлов NaOH или KOH, как групповой реактив, с солями алюминия образуют белый осадок гидроксида алюминия Al(SO4)3.
Вследствие амфотерного характера гидроксида алюминия осадок растворяется в разбавленных кислотах:
Al(OH)3 + 3HCl = AlCl3 + 3H2O и в избытке щелочи:
Al(OH)3 + NaOH = Na[Al(OH)4]
Al3+ + 3OH- = Al(OH)3↓
2. Сульфид аммония (NH4)2 из растворов солей Al3+ выделяет аморфный осадок гидроксида алюминия:
3(NH4)2S + Al2(SO4)3 + H2) = 2 Al(OH)3↓ + 3H2S↑+ 3(NH4)2SO4
3. Сухой хлорид аммония NH4Cl выделяет из растворов комплексных солей алюминия (тетрагидроксоалюминат калия) осадок гидроксида алюминия:
K[Al(OH)4] + NH4Clтв. = Al(OH)3↓ + KCl + NH3↑ + H2O
[Al(OH)4]- + NH4- = Al(OH)3↓ + NH3↑ + H2О
4. Получение «тенаровой сини». Разбавленный раствор нитрата кобальта (III) образует с солями алюминия алюминат кобальта, образующий при сжигании золу синего цвета:
2Al2(SO4)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 6SO3↑ + 4NO2↑ + O2↑
4.Напишите комплексные соединения: дицианоаргентат натрия, гексациано (III) хромат калия, бромид гексаамин кобальта(III).
- Na[Ag(CN)₂]
- K3[Cr(CN)6]
-[Co(NH3)6]Br3
5.Составьте уравнения гидролиза солей:
Cu(NO3)2, FeCl3, Rb2SO3,BaCl2, Pb(NO3)2, (NH4)2S,
| <== предыдущая | | | следующая ==> |
| Введенская (Бестужевская) волость | | | Групповой реагент, общие и фармакопейные реакции катионов V аналитической группы. |
Date: 2016-07-22; view: 501; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |