
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Адсорбция Ленгмюра из многокомпонентных систем
Виды электродов
Электродом первого рода называется электрод, потенциал которого определяется активностью катиона. Он состоит из металла, погруженного в раствор своей хорошо растворимой соли. Например, на электроде Zn⏐ZnSO4 протекает реакция Zn – 2e→Zn2+, при этом
ε =ε −Т Тст RT lnaZn2+; на электроде Cu⏐CuSo4 протекает реакция F
Cu–2e Т Тст RT lna.
→Cu2+; при этом ε =ε − 2+
F Cu
Электродом второго рода называется электрод, потенциал которого определяется активностью аниона. Он состоит из металла, погруженного в насыщенный раствор своей плохо растворимой соли, куда добавлена хорошо растворимая соль или кислота с тем же анионом.
Допустим, что серебряная пластина погружена в раствор KCl, в который помещен AgClтв (нерастворимая в воде соль):
| Ag + Cl––1e→AgClтв. Потенциал электрода | (V.16) |
| RT 1 ε =ε −Т Тст ln. F a | (V.17) |
Cl−
Схематично такой электрод изображается следующим образом:
Ag, AgClтв⏐Cl–. (V.18)
Электродом третьего рода (газовым электродом) называется электрод, потенциал которого определяется парциальным давлением газа и активностью аниона или катиона, соответствующего газу. Он состоит из металла (платины), погруженного в раствор хорошо растворимой соли, щелочи или кислоты с анионом или катионом, соответствующим газу.
Например, водородный электрод устроен следующим образом: водород обдувает платиновую пластину, погруженную в раствор кислоты. Суммарная реакция на электроде: ½ H2 – e→H+. Уравнение потенциального электрода
ε =ε −Т Тст RT ln a H +, (V.19)
0,5
F pH2
где pH0,25 – парциальное давление водорода.
VI. КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Скорость химической реакции ω – это изменение концентрации какого-либо из участников реакции за единицу времени. Она может быть выражена через изменение концентрации любого исходного вещества или продукта реакции. Например, для реакции
| А + 2В → 3С + D скорость можно вычислить по формуле | (VI.1) |
| dc 1dc 1dc dc ω A B C D, = − = − = = dt 2 dt 3 dt dt | (VI.2) |
где сА, сВ, сC, сD – концентрации веществ.
Уравнение, описывающее зависимость скорости химической реакции от концентрации, называется кинетическим.
В рамках формальной кинетики используют следующую форму кинетического уравнения:
ω=kc c cAnA BnB ini, (VI.3)
где сА, сВ, …, сn – концентрации исходных веществ; nA, nB, …, ni – порядок химической реакции по данному веществу (степень, в которой концентрации данного вещества входят в кинетическое уравнение (VI.3));
k – константа скорости химической реакции, которая зависит от температуры и имеет размерность [t]–1[c]1–n ([t] – размерность времени; [c] – размерность концентрации).
Параметр ni может быть как положительным, так и отрицательным, принимать целые и дробные значения.
N = Σni.
Общий порядок реакции равен сумме порядков реакции по всем реагирующим веществам:
Таким образом, для определения скорости химической реакции необходимо знать порядки реакции по компонентам или общий порядок реакции и константу скорости при данной температуре.
Если начальные концентрации исходных веществ берутся в стехиометрическом соотношении, то в любой момент времени соотношения между концентрациями будут равны соотношениям стехиометрических коэффициентов. Например, для реакции (VI.1), если исходная концентрация вещества В в 2 раза больше, чем для вещества А, то сВ = 2сА в любой момент времени. Тогда кинетическое уравнение можно записать в более простом виде:
dcA n nA B nA ()nB ()nB n nA B n nA B+ n
ω=− = k c c1 A B = k c1 A 2cA = k1 2 c cA A = kcA = kcA. (VI.4)
dt
Число параметров может быть существенно уменьшено также в том случае, если в начальный момент времени количество одного из реагентов значительно меньше, чем всех остальных. Тогда изменением концентраций всех реагентов, кроме выбранного, можно пренебречь и считать их концентрации постоянными. Например, если вещества А взять много меньше, чем вещества B, то значение сB можно считать константой и, соответственно,
dcA n nA B (nB) nA nA.
ω=− = k c c1 A B = k c1 B cA = kэфcA (VI.5)
dt
Таким образом, в зависимости от условий проведения химической реакции кинетика процесса различается.
Дифференциальное уравнение можно решить прямым интегрированием:
c dc
∫ n =−kt. (VI.6) c
c0
Типичные решения уравнения даны в таблице.
Выражения концентрации исходного вещества, константы скорости реакции и времени полупревращения для реакций разных порядков
| n | Зависимость концентрации от времени | k | Время полупревращения t1/2 | |
| с = –k0t + с0 | с0 − с моль k0 =, t л с⋅ | c 0 t = 1/2 k | ||
| lnс = –k1t + lnс0 | ln(с /)с 1 k1 = 0 , t с | ln2 t
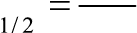 k1 k1
| ||
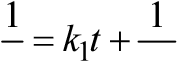 c c0 c c0
| 1 1 1 л k2 = (− ), t с с0 моль с⋅ | t = 1/2 k c2 0 | ||
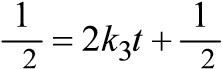 c c0 c c0
| 1 1 1 л2
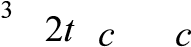 k = (2 − 2), 2 моль с
0 ⋅ k = (2 − 2), 2 моль с
0 ⋅
| t | 3 1
 2 k c3 0 2 k c3 0
| |
| n ≠ 1 | 1 1 = −(n 1)k t + −1 n n−1 cn c0 | kn = 1−n 1 1 1 [ ]с (n−1 − n−1), t n(−1) с с0 [ ]t | t 1/2 | 2n−1 1 = n −1k cn−10 n |
На основании решений уравнений, приведенных в таблице, можно понять, как определить порядок реакции из экспериментальных данных. Если имеется экспериментальная зависимость концентрации от времени при постоянной температуре, то порядок может быть определен путем подбора координат спрямления, т.е. такой зависимости, при которой некоторая функция концентрации меняется линейно со временем. Например, для первого порядка это lnс, а для второго – 1/с. Алгебраически это означает, что константа скорости, рассчитанная по уравнению, соответствующему правильно подобранному порядку реакции, не зависит от концентрации и времени.
Для описания зависимости скорости химической реакции чаще всего пользуются эмпирическим правилом Аррениуса:
dlnk E
= 2 , (VI.7) dT RT
где Е – энергия активации химической реакции.
Параметр Е может быть определен из эксперимента и имеет смысл минимальной энергии, которой должны обладать молекулы при столкновении, чтобы произошел элементарный акт реакции.
Кроме температуры скорость реакции зависит от многих факторов, в частности от присутствия других веществ, которые ускоряют (катализаторы) или замедляют (ингибиторы) скорость реакции.
Скорость инверсии тростникового сахара изучают с помощью поляриметра. Если на пути поляризованного луча поместить оптически активный раствор, то в вышедшем из раствора луче колебания молекул будут происходить уже в другой плоскости, составляющей с плоскостью колебаний первого луча некоторый угол α: раствор «поворачивает» плоскость поляризации. Угол вращения α тем больше, чем выше концентрация раствора и чем толще его слой. Угол вращения плоскости поляризации раствора, содержащий 1 г вещества в 1 см3 и действующий на поляризованный луч слоем толщиной 1 см, называется углом удельного вращения [α].
Если есть раствор, содержащий в 100 см3 с г вещества и налитый в трубку длиной l cм, и если он изменяет плоскость поляризации на угол α, то угол удельного вращения определяется соотношением
100 α
[α] =. lc
Поскольку [α] – известная постоянная величина, то, измеряя толщину слоя l, можно найти концентрацию раствора.
| А |
| В |
| О |
| О |
| ° |
| Рис. VI.1. Ход лучей в призме Николя |
Анализатор состоит из призмы Николя N3 с диафрагмой и зрительной трубой. Между поляризатором и анализатором предусмотрен зазор, в который вдоль оси прибора вставляется наполненная исследуемым раствором трубка. Поляризатор неподвижен, анализатор можно поворачивать вокруг оси прибора, при этом прикрепленный к нему указатель отмечает угол вращения.
Призма N2 поляризатора меньше, чем N1. Обе призмы расположены таким образом, что плоскости поляризации проходящих через них лучей образуют между собой некоторый угол. Вследствие этого поле зрения делится на две половины, освещенные поляризованными лучами, но с разными плоскостями поляризации. Если призму N3 анализатора поставить таким образом, чтобы плоскость поляризованных им лучей была перпендикулярна к плоскости поляризации, вызванной призмой N1 или N2, то в поле зрения будет или правая половина светлая, левая же темная, или наоборот (рис. VI.2).
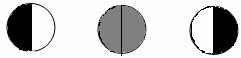
Рис. VI.2. Освещение поля зрения в зависимости от расположения анализатора N3
Если же анализатор поставить так, чтобы плоскость поляризованных им лучей была перпендикулярна к линии, делящей плоскости поляризации N1 и N2 пополам, то все поле зрения будет одинаково затемнено. Это нулевое положение анализатора. При малейшем повороте анализатора в ту или другую сторону нарушается равенство освещенности поля зрения. Угол вращения отсчитывается с помощью лупы и нониуса. Точность отсчета в различных приборах может достигать 0,05°. Приборы такого типа носят название полутеневых.
Рассмотрим оптическую схему и принцип действия полутеневого сахариметра (рис. VI.3).
Свет от источника 1 (лампа накаливания) делится на два пучка. Один из них (показан штриховой линией) служит для освещения шкалы 2 и нониуса 3 прибора, которые рассматриваются через окуляр 4. Второй пучок света проходит через светофильтр 5, выделяющий красную область спектра. Система линз 6 (конденсор) формирует параллельный пучок света, который поступает на вход поляризатора 7 (призма Николя). Получающийся плоскополяризованый свет проходит последовательно через кювету с раствором сахара 8, компенсатор 9 (клин переменной толщины, изготовленный из правовращающего кварца) и попадает на вход анализатора 10 (призма Николя или поляроидная пленка). Визуальное наблюдение осуществляется через окуляр зрительной трубы 11. Если главные плоскости пропускания поляризатора и анализатора образуют прямой угол, а оптически активное вещество между ними отсутствует, то свет через такую систему не пройдет и поле зрения трубы будет темным. В присутствии активного вещества плоскость поляризации повернется на некоторый угол и в соответствии с законом Малюса[1] интенсивность света за анализатором уже не будет равна нулю; при этом поле зрения просветляется.
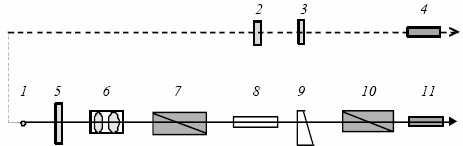
Рис. VI.3. Оптическая схема и принцип действия полутеневого сахариметра
–––––––––
Чтобы вновь добиться полного затемнения, необходимо повернуть анализатор на угол, равный углу поворота плоскости поляризации света после прохождения через активное вещество. В полутеневом сахариметре обычная призма Николя, используемая в качестве анализатора (или поляризатора), разрезана вдоль главной плоскости пропускания на две равные части. Полученные грани сошлифованы на клин под небольшим углом β = 2,0…2,5°, а затем обе половины вновь склеены. При этом плоскости пропускания П1 и П2 обеих половин анализатора (рис. VI.4) образуют между собой малый угол 2β, а круглое поле зрения разделено пополам вертикальной линией (рис. VI.5).
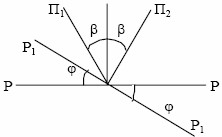
Рис. VI.4. Угол между плоскостями пропускания

| а |
| б |
| в |
Рис. VI.5. Освещение поля зрения
Если плоскость поляризации РР света, выходящего из поляризатора, перпендикулярна к биссектрисе угла между главными плоскостями половин анализатора П1 и П2, то обе половины поля зрения освещены одинаково:
I1 = I2 = I0 sin2β,
где I1 и I2 – интенсивности света, пропускаемые каждой половиной анализатора, т.е. поле зрения уже будет не полностью темным, а наполовину (рис. VI, б);
I0 – интенсивность плоскополяризованного света, падающего на анализатор.
Если плоскость РР повернется на угол α и займет положение Р1P1, то интенсивности света, выходящего из обеих половин анализатора, станут различными:
I1 = I0 sin2 (β + α); I2 = I0 sin2 (β – α).
Таким образом, даже небольшой поворот плоскости поляризации света PР после прохождения через активное вещество приводит к значительному нарушению равенства освещенностей обеих половин поля зрения (рис. VI.5, a и в). Если после установки прибора на равенство освещенностей двух половин анализатора поместить между поляризатором и анализатором исследуемое вещество, то обе половины поля зрения будут освещены неодинаково. Для восстановления равенства освещенностей анализатор следует повернуть на угол α, равный углу поворота плоскости поляризации активным веществом.
В сахариметре анализатор не вращается. Освещенность уравнивают клиновидным кварцевым компенсатором. Кварц также является оптически активным веществом, который вращает плоскость поляризации света, проходящего через него, в противоположном, чем раствор сахарозы, направлении. Смещая кварцевый клин с помощью микрометрического винта (кремальерная передача) перпендикулярно к лучу, т.е. изменяя толщину его рабочей части, можно скомпенсировать поворот плоскости поляризации раствором сахара и восстановить равную освещенность полей зрения.
Поле зрения нижнего окуляра разделено пополам вертикальной линией. Верхний окуляр служит для определения угла поворота плоскости поляризации раствором сахарозы. Оба окуляра позволяют фокусировать наблюдаемые в них изображения. Используя нониус верхнего окуляра, можно измерять угол с точность до 0,05° (аналогичный принцип используется в штангенциркуле).
VII. АДСОРБЦИЯ
Адсорбцией называется явление самопроизвольного изменения (увеличения) концентрации вещества (адсорбата) на поверхности конденсированной фазы (адсорбента).
Под физической адсорбцией понимают процесс, обусловленный молекулярными (ван-дер-ваальсовыми) силами взаимодействия адсорбента с адсорбатом. Химическая адсорбция (хемосорбция) связана с образованием поверхностных химических соединений.
При адсорбции из газовой фазы или адсорбции растворенного вещества из разбавленного раствора концентрация вещества i на поверхности может быть много больше, чем в объеме. В таком случае адсорбция Гi – это количество газа (растворенного вещества) на поверхности адсорбента.
При таком определении величина адсорбции имеет размерность моль, см3 или грамм. Часто адсорбцию относят к площади адсорбента (если она известна) или к его массе. В этих случаях адсорбция может иметь размерность моль/м2, моль/г и др.
Для описания адсорбции обычно приводят зависимость адсорбции от давления (концентрации) при постоянной температуре – изотерму адсорбции.
Теория Ленгмюра
Простейшей теорией, описывающей равновесную адсорбцию из газовой фазы или разбавленных растворов, является теория Ленгмюра. Приведем основные положения теории Ленгмюра:
1) адсорбент предоставляет адсорбату ограниченное число независимых адсорбционных мест Z, причем в каждом месте может адсорбироваться только одна молекула;
2) все адсорбционные места являются одинаковыми;
3) адсорбированные молекулы взаимодействуют с поверхностью адсорбента, но не взаимодействуют между собой.
Уравнение изотермы Ленгмюра
Zbc
Г =, (VII.1)
1+bc
где b = k↓/k↑ – константа равновесия процесса адсорбции, равная отношению констант скорости адсорбции и десорбции.
Значение Z не зависит от температуры. Так как b–константа равновесия, то
d bln ΔH
= адс2 ; (VII.2)
dT RT
ΔH
b b= o exp{ адс}, (VII.3)
RT
где ΔHадс < 0 – теплота адсорбции.
Константа адсорбции и само значение адсорбции уменьшаются с ростом температуры.
Модель адсорбции по Ленгмюру применяют не только для газовой адсорбции, но и для адсорбции растворенного вещества на поверхности растворителя в разбавленных растворах.
Адсорбция Ленгмюра из многокомпонентных систем
Если в системе имеется несколько газов (растворенных веществ), то адсорбцию каждого i-го компонента можно описать, обобщив изотерму Лангмюра на случай многокомпонентных систем, считая, что размер молекул примерно одинаков:
Zbp
Гi 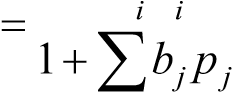 H 2GVah7Imh2HmO2LxDr53GOXsK217HKXctfo2Se61w4ZlocaOVjWVx+3JGXgbcVzO05dhfTyszl+7 u/fPdUrGXF9Ny2dQkab4F4YffEGHQpj2/sQ2qNaAPBJ/VbynhzmovWRS0EWu/6MX3wAAAP//AwBQ SwECLQAUAAYACAAAACEAtoM4kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlw ZXNdLnhtbFBLAQItABQABgAIAAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVs cy8ucmVsc1BLAQItABQABgAIAAAAIQBPkgaVaAIAAHAFAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMv ZTJvRG9jLnhtbFBLAQItABQABgAIAAAAIQB4rgfa2gAAAAIBAAAPAAAAAAAAAAAAAAAAAMIEAABk cnMvZG93bnJldi54bWxQSwUGAAAAAAQABADzAAAAyQUAAAAA ">. (VII.4)
H 2GVah7Imh2HmO2LxDr53GOXsK217HKXctfo2Se61w4ZlocaOVjWVx+3JGXgbcVzO05dhfTyszl+7 u/fPdUrGXF9Ny2dQkab4F4YffEGHQpj2/sQ2qNaAPBJ/VbynhzmovWRS0EWu/6MX3wAAAP//AwBQ SwECLQAUAAYACAAAACEAtoM4kv4AAADhAQAAEwAAAAAAAAAAAAAAAAAAAAAAW0NvbnRlbnRfVHlw ZXNdLnhtbFBLAQItABQABgAIAAAAIQA4/SH/1gAAAJQBAAALAAAAAAAAAAAAAAAAAC8BAABfcmVs cy8ucmVsc1BLAQItABQABgAIAAAAIQBPkgaVaAIAAHAFAAAOAAAAAAAAAAAAAAAAAC4CAABkcnMv ZTJvRG9jLnhtbFBLAQItABQABgAIAAAAIQB4rgfa2gAAAAIBAAAPAAAAAAAAAAAAAAAAAMIEAABk cnMvZG93bnJldi54bWxQSwUGAAAAAAQABADzAAAAyQUAAAAA ">. (VII.4)
j
Площадь удельной поверхности адсорбентов можно вычислить по формуле
Sуд = NAs0Z. (VII.5)
Поверхностное натяжение – это работа обратимого процесса по увеличению поверхности на единицу, при постоянных температуре, объеме и химических потенциалах всех компонентов (их объемных концентраций).
Простейший случай изотермы поверхностного натяжения получается, если использовать модель Ленгмюра для бесконечно разбав-
Zbc
ленных растворов Γ =2 2 совместно с адсорбционным уравне-
1+bc2
нием Гиббса:
c ∂σ
Γ =−2 2 . (VII.6)
RT c∂ 2
После соответствующей подстановки получим уравнение Шишковского
σ=σ −1 ZRT ln 1(+bc2), (VII.7)
где σ1 – поверхностное натяжение чистого растворителя; Z – число адсорбционных мест на единичной поверхности; b – константа изотермы Ленгмюра.
[1] Установлен Э.Л. Малюсом в 1810 г.
| <== предыдущая | | | следующая ==> |
| | | Соціологія у системі наукових дисциплін |
Date: 2016-05-16; view: 372; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |