
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Второе начало термодинамики. Энтропия
Все процессы, происходящие в природе, отличаются определенной направленностью, т.е. они совершаются сами собой только в одном направлении, хотя первый закон не запрещает их протекания в обратном направлении.
Необходимо ввести критерии, позволяющие определить возможность и наиболее вероятное направление, а также пределы протекания самопроизвольных процессов.
Попытки найти такой критерий привели к предположению, что самопроизвольно осуществляются только экзотермические процессы. Однако, мы знаем, что многие спонтанные термодинамические процессы, в частности химические реакции, могут протекать как с поглощением теплоты
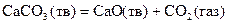
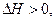
так и с ее выделение:

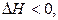
сопровождаясь возрастанием неупорядоченности систем (газ более разупорядочен, чем кристалл или жидкость).
Более того, многие реакции, например,
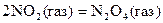
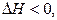
не протекают самопроизвольно, однако сопровождаются отрицательным изменением энтальпии. Поэтому – изменение внутренней энергии или энтальпии не может служить критерием, позволяющим предвидеть направление протекания процесса (реакции).
Критерии возможности направления протекания процесса определяет II закон термодинамики, который был сформулирован в 60-х годах прошлого столетия.
С его помощью решаются сформулированные выше два круга вопросов.
1) определяется возможность, направление и предел протекания термодинамического процесса в данной системе в заданных условиях.
2) устанавливаются параметры протекания термодинамического процесса в заданном направлении с необходимой полнотой.
Клаузиусом была введена функция, названная энтропией S, и сформулировано два принципа: принцип существования энтропии и принцип возрастания энтропии в изолированных системах.
Принцип существования энтропии
Для каждой термодинамической системы существует функция состояния системы S - энтропия, определяемая тем, что ее дифференциал (dS) при элементарном обратимом (равновесном) процессе равен отношению бесконечно малого количества теплоты (dq), сообщенного системе, к абсолютной температуре системы:
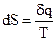 .
.
Принцип возрастания энтропии
Энтропия изолированной системы при наличии в ней необратимых процессов всегда возрастает
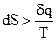 .
.
Таким образом, в изолированной системе обратимые процессы протекают без изменения энтропии, а необратимые - с возрастанием энтропии.
Свойства энтропии
Энтропия – функция состояния системы. Ее изменение зависит от начального и конечного состояний системы.
Энтропия является мерой неупорядоченности системы. 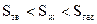 .
.
Энтропия – аддитивная функция, т.е. энтропия системы равна сумме энтропий ее частей (это экстенсивный параметр!)
Энтропия – вероятностная функция. Она показывает вероятность процесса и направление наиболее его вероятного протекания:
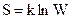 , (уравнение Больцмана)
, (уравнение Больцмана)
где W- термодинамическая вероятность; k – постоянная Больцмана. Термодинамическая вероятность – это число микросостояний, т.н. вариантов в расположении частиц (атомов молекул), которыми может быть осуществлено данное макросостояние.
Термодинамическую вероятность, которая может принимать очень большие значения, следует отличать от математической, всегда меньшей единицы.
Date: 2015-05-09; view: 703; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |