
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

VI. Рефлексивно- диагностический этап (2мин)
Задачи данного этапа: провести рефлексию по результатам учебного занятия, подвести итоги, дать качественную оценку работы класса и отдельных учащихся, выставить отметки, предложить домашнее задание.
На этом этапе учитель организует беседу с использованием записей учащихся в рабочей тетради о способах решения прямых и обратных задач на выход продукта химической реакции, получает информацию о проблемных зонах для последующей коррекции знаний и умений учащихся. Предлагает домашнее задание на выбор, дает качественную оценку работы класса и отдельных учащихся, выставляет отметки
| Деятельность учителя | Деятельность учащихся |
| Организует деятельность учащихся по осмыслению знаний и умений по способам решения прямых и обратных задач на выход продукта химической реакции, успешности достижения целей урока. Подводит итоги урока, дает качественную оценку работы класса и отдельных учащихся. Выставляет отметки. Предлагает домашнее задание на выбор (исходя из эффективности урока) | В ходе беседы с учителем осмысливают собственные знания и приобретенные умения, выявляют не усвоенные элементы знаний, сопереживают успехи учащихся класса, оценивают собственные результаты. Записывают домашнее задание: упр. 5, с.221 учебника; задание № 891 сборника задач (учитель объясняет химизм процессов записью уравнений химических реакций); или самостоятельную работу № 28, вариант 1а, 2а, 3а, 4а, 5а из сборника самостоятельных работ |
Приложение 1.
Самостоятельная работа «Элементы VIА группы и их соединения»
1.Определите химический элемент по электронной конфигурации:

2.Пользуясь периодической системой, сравните радиусы атомов, поставив знак <или >:

З. Укажите агрегатное состояние вещества:

4. Укажите области применения:

5. Укажите сумму всех элементарных частиц в нуклиде:

6. Отметьте «+» или «—» наличие или отсутствие соответствия:

7. Даны вещества: O2, H2O, NaOH, Fe, Cl2. Укажите число веществ, с которыми может реагировать:

8. Продуктом реакции H2SO4 (конц) с магнием не может быть вещество:

9.Укажите реагенты А и Б в цепочке превращений:

10. Определите молярную концентрацию вещества в растворе:
а) Н2S04 массой 42,6 г с массой воды 300 г (ρр-ра = 1,12 г/см3);
б) Н2S04 массой 115 г с массой воды 460 г (ρр-ра = 1,15 г/см3);
в) Н2S04 с массовой долей кислоты 30% (ρр-ра = 1,22 г/см3);
г) Н2S04 массой 150г с массой воды 1000 г (ρр-ра = 1,1 г/см3).
Приложение 2.
1. Поваренную соль массой 200 г обработали избытком концентрированной серной кислоты. Объем выделившегося при этом газа хлороводорода составил 70 дм3 (н. у.). Определите выход продукта реакции.
2. Кристаллический хлорид натрия массой 146,25 г обработали избытком концентрированной серной кислоты при нагревании, выход хлороводорода при этом составил 80%. Рассчитайте объем выделившегося газа (н. у.).
Приложение 3.
Контроль усвоения знаний
1. При действии на мел массой 50 г растворасерной кислоты (избыток) выделился углекислый газ объемом 10,64 дм3 (н. у.). Определите выход продукта реакции.
2.Медь массой 12,8 г опустили в раствор концентрированной серной кислоты, взятой в избытке. Рассчитайте объем выделившегося газа (н. у.), если выход продукта составляет 94 %.
Приложение 4
Практический выход продукта реакции
1. Формулы для расчета выхода продукта реакции:
1) 
2) 
3) 
4) 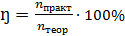
а) 1, 2, 3, 4; б) 2, 4; в) 1, 3, 4; г) 2, 3.
2. Укажите выход продукта реакции окисления оксида серы(IV) до оксида серы(VI), если объем (н.у.) выделившегося SO3 составил 30 дм3, а его теоретически возможный объем равен 35,3 дм3:
а) 84,3 %; б) 85 %; в) 81,2 %; г) 83,8 %.
3. При сжигании серы химическим количеством 1,5 моль по уравнению S + O2 = SO2 получен оксид серы(IV) химическим количеством 1,32 моль. Укажите выход продукта реакции:
а) 88 %; б) 90 %; в) 86 %; г) 87 %.
4. Укажите выход продукта реакции, если при обжиге пирита (FeS2) массой 150 кг был получен оксид серы(IV) объемом 50,4 м3(н.у.):
а) 0,85; б) 70 %; в) 0,94; г) 90 %.
5. При взаимодействии оксида кальция с углем получаются карбид кальция CaC2 и угарный газ CO. Из оксида кальция массой 16,8 г получен карбид кальция массой 15,36 г. Укажите выход карбида кальция:
а) 60 %; б) 80 %; в) 81 %; г) 0,87.
6. Укажите массу метанола, которую можно получить по уравнению
2H2 + CO = CH3OH, если водород взаимодействует с оксидом углерода(II) химическим количеством 5,5 моль, а выход метанола составляет 80 %:
а) 140,8 г; б) 115,4 г; в) 176 г; г) 148 г.
7. Укажите, какую массу раствора серной кислоты с массовой долей кислоты 92 % использовали для растворения серебра, если объем (н.у.) выделившегося оксида серы(IV) 0,78 дм3 при выходе 95 %:
а) 78 г; б) 7,5 г; в) 7,8 г; г) 11,2 г.
8. Кристаллический хлорид натрия массой 23,4 г обработали избытком концентрированной серной кислоты при нагревании. Выделившийся газ пропустили через избыток раствора нитрата серебра(I). Укажите массу образовавшегося осадка, если в первой реакции выход равен 90 %, а во второй – 100%:
а)57,4 г; б) 51, 66 г; в) 50,7 г; г) 51,26 г.
9. Оксид серы(VI) получают из серы в две стадии по схеме: S → SO2 → SO3. Укажите, какую массу оксида серы(VI) можно получить из серы массой 180 г, если выход на первой стадии 60 %, а на второй – 80%:
а) 450 г; б) 360 г; в) 216,4 г; г) 216 г.
10. Укажите, какую массу раствора с массовой долей кислоты 85 % можно получить из 0,45 т пирита с массовой долей FeS2, равной 82 %, если суммарный выход кислоты составляет 80 %:
а) 0,570 т; б) 0,710 т; в) 0,692 т; г) 0,568 т.
Приложение Б11
АММИАК
Дидактический сценарий урока по учебному предмету «Химия» в Х классе
Тема 7: Неметаллы.
Количество часов в изучаемой теме: 17.
Место урока в изучаемой теме: 9.
Цель урока: изучение строения молекулы аммиака, его химических свойств, солей аммония, применения аммиака и солей аммония.
Задачи урока:
Образовательные
· продолжить формирование начатых на II ступени представлений об аммиаке, строении его молекулы, химических свойствах, солях аммония, применении аммиака и солей аммония.
Развивающие
· развивать представления о строении молекул на примере молекулы амимиака и иона аммония;
· развивать умения составлять уравнения реакций, характеризующие химические свойства аммиака;
· развивать представления о зависимости физических и химических свойств веществ от строения, понимание взаимосвязи между свойствами веществ и их применением, умения анализировать, сопоставлять, сравнивать, обобщать, делать выводы; работать самостоятельно с учебной книгой, материалами самопроверки, схемами, таблицами;
· продолжить развитие умений анализировать, обобщать, делать выводы; работать самостоятельно с учебной книгой, слушать, владеть устной и письменной речью, сотрудничать.
Воспитательные
· прививать интерес к химии в ходе выполнения химического эксперимента;
· воспитывать экологическую культуру, обращая внимание на свойства щелочей, аммиака;
· воспитывать умение участвовать в коллективном обсуждении результатов собственной учебной деятельности.
Оборудование и реактивы:
· Учебно-методический комплекс для 10 класса.
· Штатив с пробирками, пробирка с хлоридом (сульфатом) аммония, раствор гидроксида натрия, пробирка с водой, фенолфталеин, пробка с газоотводной трубкой.
· Диагностические материалы по усвоению понятий и сформированности умений по теме «VА группа. Азот и фосфор. Физические и химические свойства простых веществ, применение» (см. приложение 1).
Тип урока: урок усвоения новых знаний.
Технология: элементы технологии развивающего обучения, проблемного обучения, технологии мастерских.
Date: 2015-11-15; view: 520; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |