
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Коваленттік байланыс
Химиялық байланыс туралы ілім — қазіргі химияның басты мәселесі. Онсыз химиялық қосылыстардың әралуандығының себебін олардың түзілу механизмін, құрылысы мен реакцияға қабілетін түсінуге болмайды.
Атомдардан молекуланың түзілуі энергияны ұтуына әкеледі, себебі кәдімгі жағдайда молекулалық күй атомдық күйге қарағанда тұрақтырақ келеді. Aтом құрылысы туралы ілім молекулалық түзілу механизмін, сол сияқты химиялық байланыстың табиғатын түсіндіреді.
Атомның сыртқы энергетикалық деңгейінде 1-ден 8-ге дейін электрон бола алады. Егер сыртқы деңгейдегі электрон саны өзі сидыра алатындай максималь болса, онда ондай деңгейді аяқталған деп атайды. Аяқталған деңгейлердің беріктігі үлкен болады, Асыл газдардың атомдарының сыртқы деңгейлері осындай: гелийдің сыртқы деңгейінде 2 электрон (s2), ал қалғандарында 8 электроннан (ns2np6) бар. Басқа элементтердің атомдарының сыртқы деңгейлері аяқталмаған, олар химиялық әрекеттесу кезінде аяқталады.
Химиялық байланыс валентті электрондардың арқасында пайда- болады, бірақта әртүрлі жолмен жасалынады. Химиялық байланыстың негізгі үш типі бар: коваленттік, иондық және металдық.
Коваленттік байланыстың пайда болу механизмін сутегі молекуласы-
ның түзілуін мысалға алып қарастырамыз:
Н + Н = Н2; АН = —431 кДж/моль.
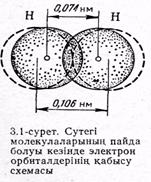
Сутегінің бос атомының ядросы ls-электроны арқылы түзілген, сфералық симметриялы электрон бүлтымен қоршалған (2.2-сур. қара). Атомдар белгілі бір қашықтыққа дейін жакындасканда олардың электрондық бұлттары (орбиталдары) бірімен-бірі аздап қаптасады (3.1-сур). Мұның нәтижесінде екі ядроның центрлерінің арасындағы кеңістікте электрондық тығыздығы максималь болатын молекулалық екі электронды бұлт пайда болады. Ал теріс зарядтың тығыздығының көбеюуі ядролар мен молекулалық бұлттың арасындағы тартылу күшінің әжептеуір артуына жағдай туғызады.
Сонымен, коваленттік байланыс; атомдардың электрон бұлттарының қаптасуы, әрі осыған орай энергия бөліп шығаруы нәтижесінде түзіледі. Егер сутегінің түйісерліктей жақындсқан атомдарының арақашықтығы 0,106 нм болса, электрондық бұлттар қатынасқаннан кейін (Н2 молекуласы түзілсе) бұл аралық 0,074 нм тең болады (3.1 - сурет). Әдетте электрондық бұлттарының көбірек қаптасуы екі атомның ядросын қосатын сызықтың бойында жатады. Электрондық орбитальдардың қаптасуы неғұрлым көбірек болса, химиялық байланыс соғұрлым берігірек болады. Сутегінің екі атомының арасында химиялық байланыстың пайда болу нәтижесінде әрбір атом асыл газ гелийдің электрондық конфигурациясына ие болады.
Химиялық байланыстарды әртүрлі етіп бейнелеу қабылданған.
1) химиялық элементтің таңбасының жанына электронды нүкте түрінде беру. Сонда сутегі молекуласының түзілуін мынадай схема бойынша көрсетуге болады:
Н• + Н• → Н: Н
2) қарама – қарсы спиндері бар екі электронды бір молекулалық квант ұяшыққа орналастырып, кванттың ұяшықтар (орбитальдар) көмегімен беру:

Сол жақ орналасқан схема молекулалық энергетикалық деңгейдің бастапқы атомдық деңгейлерден төмен, яғни заттардың молекулалық күйі атомдық күйіне қарағанда тұрақтылау екендігін көрсетеді.
3) көбінесе, органикалық химияда, коваленттік байланысты электрон жұбының символы ретінде (штрихпен) (мысалы Н - Н) бейнелеп беру.
Хлор молекулаындағы коваленттік байланыс екі жалпы электрондар немесе электрондық жұп арқылы пайда болады:
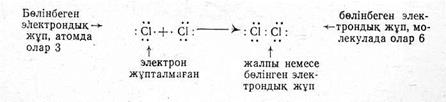
әрбір хлор атомында үш бөлінбеген жұптар және бір жұпталмаған электрон бар. Химиялық байланыстың түзілуі әрбір атомдағы жұпталмаған электрондардың арқасында іске асады. Жұпталмаған электрондар бөлінген жұп деп те аталатын жалпы электрондық жұпқа бірігеді.

Date: 2015-11-13; view: 1605; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |