
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Задания для подготовки. 1. Задание 25 № 86. При сгорании пропана выделилось 60 л углекислого газа
1. Задание 25 № 86. При сгорании пропана выделилось 60 л углекислого газа. Объем пропана был равен
1) 20 л
2) 60 л
3) 80 л
4) 180 л
2. Задание 25 № 129. При полном сгорании 2 л углеводорода образовалось 8 л паров воды (объемы газов измерены при одинаковых условиях).
Формула углеводорода – …
1) 
2) 
3) 
4) 
3. Задание 25 № 215. Для получения 56 л (н.у.) углекислого газа, согласно уравнению реакции

необходимо затратить теплоту в количестве
1) 90 кДж
2) 180 кДж
3) 450 кДж
4) 540 кДж
4. Задание 25 № 258. В соответствии с термохимическим уравнением

при сгорании 44,8 л этена (н.у.) выделяется теплота в количестве
1) 700 кДж
2) 2800 кДж
3) 2100 кДж
4) 10 500 кДж
5. Задание 25 № 301. Согласно уравнению реакции

при сжигании оксида углерода (II) выделилось 152 кДж теплоты. Объем (н.у.) сгоревшего газа составил
1) 6 л
2) 12 л
3) 44,8 л
4) 120 л
6. Задание 25 № 344. При образовании аммиака, согласно уравнению реакции
 ,
,
выделилось 230 кДж теплоты. При этом объем (н.у.) вступившего в реакцию водорода составил
1) 44,8 л
2) 56 л
3) 112 л
4) 168 л
7. Задание 25 № 387. Для получения 22,4 г железа, согласно уравнению
 ,
,
потребуется затратить теплоты
1) 4,48 кДж
2) 5,4 кДж
3) 12 кДж
4) 13,5 кДж
8. Задание 25 № 430. В результате реакции, термохимическое уравнение которой
 ,
,
выделилось 265 кДж теплоты.
Масса образовавшегося при этом оксида меди (II) равна
1) 40 г
2) 80 г
3) 160 г
4) 190 г
9. Задание 25 № 473. При окислении 4,8 г угля до оксида углерода (II), согласно уравнению
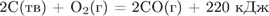 ,
,
выделится теплота в количестве
1) 22 кДж
2) 44 кДж
3) 88 кДж
4) 220 кДж
10. Задание 25 № 516. В соответствии с термохимическим уравнением

для получения 2111 кДж теплоты необходимо затратить кислород объемом (н. у.)
1) 100 л
2) 110 л
3) 120 л
4) 130 л
11. Задание 25 № 559. Какой объём (н.у.) водорода теоретически необходим для синтеза 100 л (н.у.) аммиака?
1) 150 л
2) 100 л
3) 50 л
4) 75 л
12. Задание 25 № 602. В реакцию, термохимическое уравнение которой

вступило 8 г оксида магния. Количество выделившейся при этом теплоты равно
1) 102 кДж
2) 204 кДж
3) 20,4 кДж
4) 1,02 кДж
13. Задание 25 № 645. Объём (н.у.) углекислого газа, который теоретически образуется при сжигании 5 л (н.у.) угарного газа, равен
1) 5 л
2) 2,5 л
3) 7,5 л
4) 10 л
14. Задание 25 № 688. В соответствии с термохимическим уравнением реакции

количество теплоты, необходимое для разложения 1,7 г нитрата серебра, составляет
1) 31,7 кДж
2) 1,585 кДж
3) 3,17 кДж
4) 15,85 кДж
15. Задание 25 № 731. В соответствии с термохимическим уравнением

при получении 200 г оксида магния количество выделившейся теплоты будет равно
1) 1860 кДж
2) 465 кДж
3) 620 кДж
4) 930 кДж
16. Задание 25 № 774. В соответствии с термохимическим уравнением

для получения 10,8 г серебра необходимо затратить теплоту в количестве
1) 31,7 кДж
2) 158,5 кДж
3) 5,3 кДж
4) 15,85 кДж
17. Задание 25 № 817. B результате реакции, термохимическое уравнение которой

выделилось 5,74 кДж теплоты. Объём (н.у.) получившегося при этом кислорода составил
1) 100 л
2) 0,224 л
3) 1,568 л
4) 4,48 л
18. Задание 25 № 860. В ходе реакции
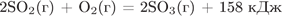
выделилось 395 кДж тепла. Чему равна масса оксида серы (VI), полученного при этом?
1) 80 г
2) 160 г
3) 200 г
4) 400 г
19. Задание 25 № 903. В соответствии с термохимическим уравнением

1206 кДж теплоты выделяется при горении угля массой
1) 72 г
2) 36 г
3) 7,2 г
4) 108 г
20. Задание 25 № 946. Какой объём (н.у.) кислорода потребуется для полного сгорания 10 л (н.у.) ацетилена?
1) 20 л
2) 5 л
3) 50 л
4) 25 л
21. Задание 25 № 989. Согласно термохимическому уравнению реакции

при получении 31,36 л (н.у.) оксида азота (II) количество выделившейся теплоты будет равно
1) 71,6 кДж
2) 501,2 кДж
3) 250,6 кДж
4) 224 кДж
22. Задание 25 № 1032. Какой объём (н.у.) кислорода необходим для окисления 40 л (н.у.) оксида азота (II)?
1) 40 л
2) 20 л
3) 80 л
4) 60 л
23. Задание 25 № 1075. Согласно термохимическому уравнению реакции

при получении 15,68 л (н.у.) оксида азота (II) количество выделившейся теплоты будет равно
1) 358 кДж
2) 716 кДж
3) 125,3 кДж
4) 22,4 кДж
24. Задание 25 № 1118. В результате реакции, термохимическое уравнение которой

выделилось 114,8 кДж теплоты. Объём (н.у.) получившегося при этом кислорода составил
1) 200 л
2) 4,48 л
3) 31,36 л
4) 8,96 л
25. Задание 25 № 1161. Для получения 25 г железа, согласно уравнению

потребуется затратить теплоты
1) 4,8 кДж
2) 6 кДж
3) 12 кДж
4) 13,5 кДж
26. Задание 25 № 1204. В результате реакции, термохимическое уравнение которой
 ,
,
выделилось 5,74 кДж теплоты. Объём (н.у.) получившегося при этом кислорода составил
1) 100 л
2) 0,224 л
3) 1,568 л
4) 4,48 л
27. Задание 25 № 1247. В соответствии с термохимическим уравнением

для получения 1970 кДж теплоты необходимо затратить кислород объемом (н.у.)
1) 2,24 л
2) 11,2 л
3) 112 л
4) 224 л
28. Задание 25 № 1290. В соответствии с термохимическим уравнением

для получения 2111 кДж теплоты необходимо затратить кислород объёмом (н.у.)
1) 100 л
2) 110 л
3) 120 л
4) 130 л
29. Задание 25 № 1333. При окислении 4,8 г угля до оксида углерода (II), согласно уравнению

выделится теплота количеством
1) 22 кДж
2) 44 кДж
3) 220 кДж
4) 88 кДж
30. Задание 25 № 1376. В результате реакции, термохимическое уравнение которой
 ,
,
выделилось 795 кДж теплоты. Масса образовавшегося при этом оксида меди (II) равна
1) 30 г
2) 240 г
3) 60 г
4) 90 г
31. Задание 25 № 1419. В соответствии с термохимическим уравнением

120,6 кДж теплоты выделяется при горении угля массой
1) 10,8 г
2) 3,6 г
3) 14,4 г
4) 1,8 г
32. Задание 25 № 1462. Какой объём (н.у.) кислорода потребуется для полного сгорания 6 л (н.у.) ацетилена?
1) 6,72 л
2) 1,5 л
3) 5 л
4) 15 л
33. Задание 25 № 1506. В результате реакции, термохимическое уравнение которой

выделилось 652,5 кДж теплоты. Объем прореагрировавшего ацетилена равен:
1) 11,2 л
2) 22,4 л
3) 44,8 л
4) 67,2 л
Date: 2015-11-13; view: 929; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |