
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основні характеристики хімічного зв’язку
Хімічний зв’язок в молекулах зумовлений перекриванням валентних орбіталей взаємодіючих атомів і супроводжується зменшенням повної енергії системи. В залежності від способу перекривання і симетрії орбіталі, що утворюється, розрізняють σ-, π- і δ-зв’язки.
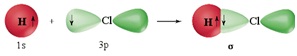
σ -Зв’язок (сигма-зв’язок) утворюється в результаті перекривання електронних орбіталей уздовж лінії, що з’єднує центри атомів. У випадку σ -зв’язку відбувається максимальне перекривання орбіталей і тому, саме σ-зв’язок відповідає за геометрію молекули.
Між двома атомами можливий тільки однин σ-зв’язок:

π -Зв’язок (пі-зв’язок) виникає в результаті перекривання атомних орбіталей вздовж ліній, перпендикулярних тій, що з’єднує центри атомів (тобто ділянка перекривання знаходиться над і під лінією, що з’єднує центри атомів):
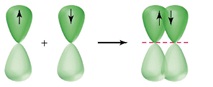
В результаті додаткового перекривання атомних орбіталей за рахунок π-зв’язку між атомами виникають кратні зв’язки: одинарний (F – F); подвійний (O=O); потрійний (N≡N).
Хімічний ковалентний зв’язок характеризується довжиною, валентним кутом і енергією.
Довжина зв’язку – відстань між ядрами атомів, що утворюють сполуку. Довжини зв’язків зазвичай знаходяться в межах від 0,1 до 0,27 нм (Н2 – 0,075; N2 – 0,110; О2 – 0,121, I2 – 0,267). Зміна довжин зв’язків в схожих сполуках пов’язана зі зміною ефективних радіусів елементів, що входять в ці сполуки, наприклад, для HF, HCl, HBr і HI довжини зв’язків змінюються відповідно: 0,100; 0,127; 0,141; 0,162 нм.
Валентний кут – кут між уявними лініями, що з’єднують центри атомів у напрямі дії хімічного зв’язку:

Валентні кути, як і довжини зв’язків, експериментально визначають з високою точністю.
Характеристикою міцності хімічного зв’язку є енергія зв’язку Езв – енергія, яка необхідна для розриву (дисоціації) зв’язків в молекулі з одержанням нейтральних атомів. Вимірюється в електронвольтах (еВ) для одного зв’язку або в кДж/моль для одного моля зв’язків. Так, енергія зв’язку Н-Н в молекулі Н2 рівна 435 кДж/моль, а середня енергія одного зв’язку С-Н у багатоатомній молекулі СН4 рівна Едисс (СН4 /4) = 1648/4 = 412 кДж/моль.
Date: 2015-12-11; view: 465; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |