
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Уравнение состояния сухого воздуха
Состояние каждого из атмосферных газов характеризуется значениями трех величин: температуры, давления и плотности (или удельного объема). Эти величины всегда связаны между собой некоторым уравнением, которое носит название уравнения состояния газа.
Для каждого газа существует так называемая критическая температура Ткр. Если температура газа выше критической, то ни при каком давлении газ не может быть переведен в жидкое или твердое состояние, т. е. при Т > Ткр возможно только газообразное состояние вещества. Критические температуры атмосферных газов имеют следующие значения:

Из этих данных видно, что критические температуры всех атмосферных газов, кроме углекислого газа и водяного пара, очень низкие. Температуры, которые наблюдаются в атмосфере на всех высотах, значительно выше критических температур этих газов. Хотя критическая температура углекислого газа выше, чем обычно наблюдаемые температуры воздуха, этот газ далек от состояния насыщения, поскольку его парциальное давление в условиях атмосферы мало.
По своим физическим свойствам газ тем ближе к идеальному, чем выше его температура по сравнению с критической, а также чем меньше его давление по сравнению с давлением насыщения.
При условиях, наблюдающихся в атмосфере, основные газы, входящие в состав воздуха, ведут себя практически как идеальные газы. Поэтому уравнение состояния какого-либо газа имеет вид уравнения состояния идеального газа:

где pi — парциальное давление; Т — температура; Vi — удельный объем; Ri — удельная газовая постоянная i-гo газа; п — число газов, составляющих механическую смесь.
Удельная газовая постоянная Ri; связана с универсальной газовой постоянной R*= 8,31441 103 Дж/(кмоль • К) следующим соотношением:

где μi — относительная молекулярная масса 1-го газа.
Согласно закону Дальтона, поведение каждого газа в механической смеси не зависит от присутствия других газов, а общее давление смеси равно сумме парциальных давлений, т. е.

Пусть масса сухого воздуха равна единице, а масса i-гo газа mi Тогда

где v — удельный объем сухого воздуха.
Подставляя vi в соответствии с (1.3.4) в формулу (1.3.1) и суммируя уравнения (1.3.1), получаем:
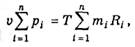
или, согласно (1.3.3),

где Rc — удельная газовая постоянная сухого воздуха:

Уравнение (1.3.5) и представляет собой уравнение состояния сухого воздуха.
Таким образом, уравнение состояния сухого воздуха имеет тот же вид, что и уравнение состояния идеального газа. При этом удельная газовая постоянная воздуха определяется как среднее взвешенное из парциальных газовых постоянных по формуле (1.3.6).
С учетом формулы (1.3.2) и данных о составе воздуха (см. п. 1.1) получаем следующее значение удельной газовой постоянной сухого воздуха:

Относительную молекулярную массу сухого воздуха по углеродной шкале можно получить при известных Rc и R*по соотношению

Если вместо удельного объема v в уравнение (1.3.5) ввести плотность р, связанную с v соотношением р = l/v, то оно примет вид

Наряду с таким видом уравнения состояния широкое распространение, особенно при изучении верхних слоев атмосферы, получила другая форма записи его. Эта форма легко получается из уравнения (1.3.5), если левую и правую части его умножить на μс:

где V = μс v объем моля воздуха. При фиксированных р и Т объем V, согласно (1.3.9), для всех газов одинаков. Например, при Т = О °С и р = 1013,2 гПа объем Vo = 22,41 м3/кмоль.
Если теперь разделить левую и правую части (1.3.9) на число молекул воздуха в одном моле (N), то получим:

Где

Поскольку число молекул в одном моле — число Авогадро — для всех газов одинаково (N = 6,02 • 1026 кмоль"1), то величина к представляет собой тоже универсальную постоянную, называемую постоянной Больцмана:

Следовательно, уравнение состояния воздуха, равно как и любого другого газа, можно записать также в следующем виде:

где п = N/V — число молекул воздуха в 1 м3, которое, как следует
ИЗ (1.3.12), При фиксированных р и Т одинаково для всех газов: при Т = 0 º С и р = 1013,2 гПа, п = 2,687 · 1025 м-3.
Из уравнений (1.3.8) и (1.3.12) следует

Откуда

где m=μс / N - средняя масса одной молекулы воздуха.
Date: 2015-12-10; view: 2664; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |