
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергетика химических реакций
Кафедра химии
ОСНОВЫ ХИМИЧЕСКОЙ
ТЕРМОДИНАМИКИ, КИНЕТИКИ,
РАВНОВЕСИЯ И ЭЛЕКТРОХИМИИ
Методические указания
для студентов специальности 060800
«Экономика и управление на предприятии
(в строительстве)» заочной формы обучения
НОВОСИБИРСК 2003
Методические указания составлены канд. хим. наук, доцентом В.Л. Саленко
Утверждены методической комиссией факультета ВиЗО 23 мая 2003 года
Рецензент:
- О.П. Слюдкин, канд. хим. наук, доцент кафедры общей химии НГУ

Новосибирский государственный архитектурно-строительный университет, 2003
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ
Энергетика химических реакций
К важнейшим величинам, характеризующим химические системы, относятся внутренняя энергия U, энтальпия Н, энтропия S, и энергия Гиббса S (изобарно-изотермический потенциал). Все эти величины являются функциями состояния системы, т.е. зависят только от состояния системы, а не от способа, которым это состояние достигнуто.
Протекание химической реакции сопровождается изменением внутренней энергии реагирующих систем. Если внутренняя энергия системы уменьшается (∆U < 0), то реакция протекает с выделением энергии (экзотермические реакции). Если внутренняя энергия возрастает (∆U > 0), то процесс сопровождается поглощением энергии из внешней среды (эндотермические реакции).
Если в результате протекания химической реакции система поглотила количество теплоты Q и совершила работу W, то изменение внутренней энергии ∆U определяется уравнением:
∆U = Q-W.
Согласно закону сохранения энергии. ∆U зависит только от
начального и конечного состояния системы, но не зависит от спо-
соба осуществления процесса (реакции). Напротив, величины Q и
W при разных Способах осуществления процесса будут различать-
ся: функцией состояния является только разность этих величин, но
не каждая их них в отдельности. Функции U, Q и W измеряются в
джоулях (Дж) или килоджоулях (кДж).
Если реакция протекает при постоянном объеме (∆V = 0, изо-хорный процесс), то работа расширения системы (W = P∆V) равна нулю. Если при этом не совершаются другие виды работы (например, электрическая), то ∆U = Qv, где Qv - тепловой эффект реакции, протекающей при постоянном объеме.
Химические реакции чаще всего протекают при постоянном давлении Р (∆Р = 0, изобарный процесс). В подобных случаях удобнее пользоваться не внутренней энергией U, а энтальпией Н, которая определяется соотношением:
H = U + P∆V.
Энтальпия имеет ту же размерность, что и внутренняя энергия и выражается в джоулях (Дж) и килоджоулях (кДж).
При постоянном давлении изменение энтальпии равно сумме изменения внутренней энергии (∆U) и совершенной системой работы расширения (Р∆V)
DH= DU + PDV
Если единственным видом работы является работа расширения, то ∆Н = Qp, где Qp - тепловой эффект реакции, протекающей при постоянном давлении.
Изменение внутренней энергии или энтальпии обычно рассматривают для веществ, находящихся в стандартных Состояниях. Стандартным состоянием вещества при данной температуре называют его состояние в виде чистого вещества при давлении, равном нормальному атмосферному давлению (101,325. кПа или 760 мм рт.ст.) и данной температуре. Так, при комнатной температуре стандартным состоянием воды будет жидкое, при температуре ниже
О °С - твердое, а выше 100 °С - газообразное.
Тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при 298 К и давлении 100 кПа называют энтальпией (теплотой) образования. Энтальпию образования вещества В обозначают DНобр,В или DНf,В.
Энтальпию образования простых веществ, устойчивых при 298 К и давлении 100 кПа, принимают равной нулю. Нулевое значение энтальпии образования имеет фаза или модификация вещества наиболее устойчивая при стандартных условиях, например, газообразный кислород, жидкий бром, белый фосфор.
Стандартной энтальпией образования химического соединения (∆Нобр,В, или, ∆Hf,B) называется стандартная энтальпия образования 1 моля данного вещества из соответствующих простых веществ, взятых в стандартных состояниях.
Табличные значения стандартных энтальпий образования веществ приводятся для 25 °С (298 К). Обычная форма записи (значок«0» обозначает стандартную величину) ∆Н0f,H2O(ж),298 = -285,8 кДж/моль. Если данные приведены при 25 °С, указание температуры часто опускается: ∆Н0f,H2O(ж) = -285,8 кДж/моль.
Большинство реализуемых на практике процессов осуществляется при постоянном давлении. В этих условиях тепловой эффект
реакции определяется изменением энтальпии реакции ∆Нг или просто энтальпией реакции. В эндотермическом процессе энтальпия системы возрастает (∆Нг > 0), а в экзотермическом убывает (∆Нг < 0).
Уравнения реакций, в которых около символов химических соединений указывается их агрегатное состояние (или кристаллические модификации) и численные значения тепловых эффектов (при Р = const) равные DHг, называют термохимическими. Значение ∆Нг приводят обычно в правой части уравнения, отделяя его запятой. Например:
2СО(г) + O2(г) = 2СО2(г), ∆Нг=-566 кДж.
Приняты следующие сокращения обозначений агрегатных состояний веществ: г - газообразное, ж - жидкое, к - кристаллическое.
Указывая энтальпии реакций всегда необходимо приводить
само уравнение реакции, так как численная величина энтальпии реакции зависит от формы написания уравнения. В термохимических
уравнениях допустимы дробные коэффициенты, так как они означают число молей вещества, а не молекул. Так, последняя реакция
может быть записана в форме:
СO(г) + 1/2O2(г) = СO2(г).
Для неё ∆Нг = -283 кДж - в два раза меньше, чем в предыдущей записи. В соответствии с определением стандартным значением энтальпии образования СО2 будет величина АН0г = -283 кДж. Табличные значения энтальпий образования химических соединений используют для расчета энтальпий химических реакций.
Термохимические расчеты основаны на законе Гесса:
Тепловой эффект химической реакции зависит только от начального и конечного состояний участвующих в реакции веществ и не зависит от промежуточных стадий процесса (пути реакции).
Из закона Гесса следует, в частности, что термохимические уравнения можно складывать, вычитать и умножать на численные множители. Это позволяет сформулировать следствие закона Гесса, применение которого упрощает многие химические расчеты.
Стандартная энтальпия химической реакции равна сумме стандартных энтальпий образования продуктов реакции за вычетом суммы стандартных энтальпий образования исходных веществ.
DН 0г —SniDH 0f продуктов - SDniH 0f, исходных веществ,
где ni - стехиометрические коэффициенты пред формулами веществ в уравнении реакции.
Пример 1. Рассчитайте изменение энтальпии реакции обжига пирита.
4FeS2 (к) + 11О2 (г) = 2Fe2O3 (к) + 8SO2 (г).
Решение. Изменение энтальпии реакции ∆Нг можно вычислить, пользуясь значениями стандартных энтальпий образования химических соединений
DН0г = SniH0f, прод. - SniH0f, исх.
Для реакции, соответствующей DН0f,O2 = 0, так как кислород -простое вещество, a DH°f образования простых веществ приняты равными нулю.
Необходимые данные для расчета DH0f находят в таблице термодинамических величин: DH0f, Fe2O3 = -821,3 кДж/моль; DH0f, SO2 =
-296,9 кДж/моль; DH0f,FeS2 = -163,3 кДж/моль.
Подставляя в уравнение DH0f образования соответствующих веществ, вычисляем DH0r реакции;
DН0г = 2(-821,3) + 8(-296,9) - 4(-163,3) = -1642,6.- 2375,2 + +653,2 =-3364,6 кДж.
Отрицательное значение энтальпии реакции обжига означает, что данная реакция экзотермическая.
Пример 2. Найдите стандартную энтальпию образования гидразина, воспользовавшись термохимическим уравнением:
N2H4 (ж) + 2I2 (к) = 4HI (г) + N2 (г), ∆Н0г = 55,7 кДж.
Решение. Энтальпии образования веществ связаны с энтальпией реакции:
DH0r = 4DH0f,HI-DH0f,N2H4.
Зная DН0г= 55,7 кДж и находя в таблице необходимую термодинамическую величину ∆H0f,HI = 26,6 кДж/моль, вычисляем DH0f,N2H4
DH0f, N2H4 = 4DH0f, hi - DН0г = 4∙26,6 - 55,7 = 50,7 Дж/моль,
Для образования 1 моль гидразина N2H4 (ж) в стандартном состоянии из простых веществ необходимо затратить 50,7 кДж.
Пример 3. При взаимодействии металлического калия с водой
выделяется тепло. Определите, какая масса калия прореагировала,
если выделилось 28,3 кДж теплоты.
|
Решение. Bee расчеты в термохимии проводят по уравнениям реакций, поэтому необходимо написать уравнение реакции калия с водой
К (к) + Н2О (ж) = КОН (к) + 1/2 Н2 (г).
Если прореагирует весь калий, т.е. 1 моль, то выделившаяся теплота будет соответствовать энтальпии реакции (∆Н0г). Вычислим ∆Н0г, пользуясь табличными данными энтальпии образования:
DH0f, H2O(ж) = -285,8 кДж/моль; ∆H0f, КОН (к) = -425,8 кДж/моль,
DН0г = DH0f, KOH - DН0f, H2O = (-425,8) - (-285,8) = - 140,0 кДж.

|
Зная, сколько теплоты выделяется при взаимодействии 1 моль
калия (39 г) с водой, можно вычислить массу прореагировавшего
калия, если выделяется 28,3 кДж теплоты. Для этого составляют пропорцию:

|
|
Пример 4. Рассчитайте количество теплоты, выделяющейся при сгорании 11,2 л сероводорода (условия нормальные).
Решение. Запишем уравнение реакции горения сероводорода:

Если в реакцию вступает 1 моль H2S(г), т.е. 22,4 л (при н.у.
1 моль любого газообразного вещества занимает объем 22,4 л), то
выделяющаяся теплота соответствует ∆Н0г.
Вычислим ∆Н0г, пользуясь следствием закона Гесса и табличными значениями стандартных энтальпий образования соответствующих веществ:

Определим количество выделившейся теплоты, если сгорает 11,2 л H2S(r), составив и решив пропорцию:
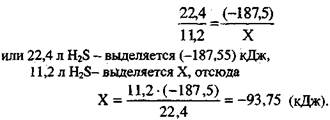
Date: 2015-10-21; view: 823; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |