
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Молекулалық физика және термодинамика
Дененің (жүйенің) зат мөлшері

Мұндағы N – денені құрайтын құрылымдық элементтер (молекулалар, атомдар, иондар және т.т) саны; N A – Авагадро тұрақтысы (N A=6,02×1023 моль-1)
Заттың мольдік массасы

Мұндағы, m – біртекті дененің (жүйенің) массасы; n – осы дененің зат мөлшері;
Заттың салыстырмалы молекулалық массасы

Мұндағы n i – берілген затты молекуласының құрамына кіретін і -нші химиялық элементтің атомдарының саны; A ri – осы элементтің салыстырмалы атомдық массасы. Салыстырмалы атомдық масса Д.И. Менделеевтің периодтық кестесінде көрсетілген. Заттың М молярлық массасы мен салыстырмалы молекулалық массасының арасындағы байланыс мынадай:

мұндағы, k =10-3кг/моль.
Газ қоспасының зат мөлшері,

Мұндағы, nі, N і, m і, M і – і -нші компоненттің сәйкес зат мөлшері, молекула саны, массасы, молярлық массасы.
Клапейрон-Менделеев теңдеуі (идеал газ күйінің теңдеуі)

Мұндағы, m – газ массасы, M – газдың молярлық массасы, R – универсал газ тұрақтысы, n – зат мөлшері, T – термодинамикалық температура.
Изопроцестер үшін Клапейрон-Менделеев теңдеуінің жеке жағдайы болып саналатын тәжірибелік газ заңдары:
а) Бойль-Мариотт заңы (изотермиялық процесс: Т =const, m =const)

немесе газдың екі күйі үшін,

б) Гей-Люссак заңы (изобаралық процесс: p =const, m =const)

немесе газдың екі күйі үшін,

в) Шарль заңы (изохоралық процесс, V =const, m =const)

немесе газдың екі күйі үшін,

г) біріккен газ заңы (m =const),
 немесе
немесе 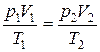
мұндағы, p 1, V 1, T 1 газдың бастапқы күйіндегі қысымы, көлемі және температурасы; p 2, V 2, T 2 – соңғы күйіндегі шамалар.
Газ қоспасының қысымын анықтайтын Дальтон заңы

мұндағы, p i – қоспа компоненттерінің парциаль қысымдары; n – қоспадағы компоненттер саны.
Парциаль қысым деп егер осы газ, қоспа тұрған ыдыста жалғыз өзі қалғанда туғызатын қысымды айтады.
Газ қоспасының молярлық массасы

Мұндағы m i – қоспаның і -нші компонентінің массасы;  – қоспаның і -нші компонентінің зат мөлшері; n – қоспадағы компоненттер саны. Газ қоспасындағы і -нші компоненттің массалық үлесі (бірліктер үлесі немесе проценті)
– қоспаның і -нші компонентінің зат мөлшері; n – қоспадағы компоненттер саны. Газ қоспасындағы і -нші компоненттің массалық үлесі (бірліктер үлесі немесе проценті)
 ,
,
мұндағы, m – қоспаның массасы.
Молекулалардың концентрациясы (шоғыры)
 ,
,
мұндағы, N – берілген жүйедегі молекулалар саны; r – заттың тығыздығы; V – жүйенің көлемі.
Бұл формула тек ғана газдар үшін ғана емес, кез-келген заттың агрегаттық күйі үшін дұрыс.
Газдың молекула-кинетикалық теориясының негізгі теңдеуі
 ,
,
мұндағы, <e> – молекуланың ілгерімелі қозғалысының орташа кинетикалық энергиясы.

мұндағы, k – Больцман тұрақтысы.
Молекуланың орташа толық кинетикалық энергиясы.

мұндағы, і – молекулалардың еркіндік дәрежесінің саны. Газ қысымының молекулалар концентрациясы мен температураға тәуелділігі,

Молекулалардың жылдамдығы:
 — орташа квадраттық;
— орташа квадраттық;
 — орташа арифметикалық;
— орташа арифметикалық;
 — екі ықтимал;
— екі ықтимал;
мұндағы, m0— бір молекуланың массасы.
Молекуланың салыстырмалы жылдамдығы 
Мұндағы u – берілген молекуланың жылдамдығы. Тұрақты көлем және тұрақты қысым кезіндегі газдың меншікті жылу сыйымдылығы (с р)
 ,
, 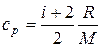
Меншікті с және молярлық С сыйымдылықтар арасындағы байланыс мынандай:
 ,
, 
Майер теңдеуі:
 .
.
Идеал газдың ішкі энергиясы,

Термодинамиканың бірінші бастамасы

Мұндағы, Q – жүйеге (газға) берілген жылу мөлшері; D U – жүйенің ішкі энергиясының өзгерісі; А – жүйенің сыртқы күштерге қарсы жасаған жұмысы.
Газдың ұлғаюы кезінде жасаған жұмысы:



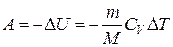 немесе
немесе 
Адиабаталық процесте, мұндағы,  – адиабата көрсеткіші.
– адиабата көрсеткіші.
Адиабаталық процесте идеал газ параметрлерін байланыстыратын Пуассон теңдеулері:
 ,
, 

 ,
, 
Циклдің термиялық коэффиценті (ПӘК-і)

Мұндағы, Q1 – жұмыс денесінің жылубергіштен алған жылу мөлшері; Q2 – жұмыс денесінің жылу қабылдағышқа берген жылу мөлшері.
Карно циклінің термиялық коэффиценті (ПӘК-і),

Мұндағы, Т1 және Т2 – жылубергіш пен жылу қабылдағыштың термодинамикалық температурасы.
Беттік керілу коэффиценті

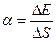
Мұндағы, F – сұйық беті шектелетін l контурға әсер ететін беттік керілу күші; D Е – осы пленка бетінің DS ауданының өзгерісіне байланысты сұйық пленкасының еркін энергиясының өзгерісі.
Сұйықтың сфералық бетінің туғызатын р қысымын өрнектейтін Лаплас формуласы:

Мұндағы, R – сфералық беттің радиусы.
Капилляр түтіктегі сұйықтың көтерілу биіктігін анықтайтын формула,

мұндағы, q – жиектік бұрыш (толық жұғу болғанда q=0, ал жұқпайтын болғанда q=p)
R– түтіктің радиусы; r – сұйықтың тығыздығы, g – еркін түсу үдеуі.
Өзара жақын орналасқан және бір-біріне параллель екі жазықтықтың арасындағы сұйықтың көтерілу биіктігі мынаған тең,

Мұндағы, d – жазықтықтардың арақашықтығы.
Date: 2015-10-19; view: 3207; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |