
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электрохимические процессы
Если металлическую пластинку опустить в воду, то катионы металла на ее поверхности гидратируются полярными молекулами воды и переходят в жидкость. При этом электроны, в избытке остающиеся в металле, разряжают его поверхностный слой отрицательно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла. В результате этого в системе устанавливается подвижное равновесие:
Me + т Н2О ↔Ме (Н2О) пт+ + пе -
где п – число электронов, принимающих участие в процессе.
На границе металл — жидкость возникает двойной электрический слой, характеризующийся определенным скачком потенциала — электродным потенциалом. Абсолютные значения электродных потенциалов измерить не удается. Электродные потенциалы зависят от ряда факторов (природы металла, концентрации, температуры и др.). Поэтому обычно определяют относительные электродные потенциалы в определенных условиях — так называемые стандартные электродные потенциалы (Е°).
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью), равной 1 моль/л,измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25°С условно принимается равным нулю (Е° = 0; ∆ G° = 0).
Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е°), получаем ряд стандартных электродных потенциалов (ряд напряжений).
Положение того или иного металла в ряду стандартных электродных потенциалов (ряд напряжений) характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение Е°, тем большими восстановительными способностями обладает данный металл в виде простого вещества и тем меньшие окислительные способности проявляют его ионы, и наоборот. Электродные потенциалы измеряют приборами, которые называют гальваническими элементами. Окислительно-восстановительная реакция, которая характеризует работу гальванического элемента, протекает в направлении, в котором ЭДС элемента имеет положительное значение.
Пример. Составьте схему гальванического элемента, и котором электродами являются магниевая и цинковая пластинки, опущенные в растворы их ионов с активной концентрацией 0,1 моль/л. Какой металл является анодом, какой катодом? Напишите уравнение окислительно-восстановительной реакции, протекающей в этом гальваническом элементе, и вычислите его ЭДС.
Решение. Схема данного гальванического элемента
(-) Mg | Mg2+ || Zn2+ | Zn (+)
Вертикальная линейка обозначает поверхность раздела между металлом и раствором, а две линейки — границу раздела двух жидких фаз — пористую перегородку (или соединительную трубку, заполненную раствором электролита). Магний имеет меньший потенциал (-2,37 В) и является анодом, на котором протекает окислительный процесс:
Mg° - 2e- = Mg2+ (1)
Цинк, потенциал которого -0,763В, — катод, т.е. электрод, на котором протекает восстановительный процесс:
Zn2+ + 2e- = Zn° (2)
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, можно получить, сложив электронные уравнения анодного (1) и катодного (2) процессов:
Mg+ Zn2+ = Mg2+ + Zn
Электродный потенциал металла (Е)зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста:
 ,
,
где Е° — стандартный электродный потенциал; п — число электронов, принимающих участие в процессе; С— концентрация (при точных вычислениях — активность) гидратированных ионов металла в растворе, моль/л; Е° — для магния и цинка соответственно равны -2,37 В -0,763 В. Определим электродные потенциалы этих металлов при заданных концентрациях:


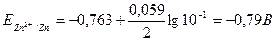
Для определения ЭДС гальванического элемента из потенциала катода следует вычесть потенциал анода.
ЭДС = Е (Zn2+ /Zn) – E (Mg2+ /Mg) = -0,79 – (-2,40) = 1,61 В.
Для заданий 45 - 55 составьте схему, напишите уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из двух металлов, опущенных в 0,1 М раствор нитратов этих металлов, если металлы:
45. Серебро и медь. 46. Медь и магний. 47.Хром и медь. 48. Никель и цинк. 49. Серебро и хром. 50. Магний и железо. 51. Олово и серебро. 52. Свинец и кобальт. 53. Олово и цинк. 54. Железо и никель. 55. Серебро и олово.
Контрольные задания №6
Date: 2015-10-19; view: 721; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |