
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Понятие о степени окисления
Для характеристики состояния элементов в соединениях введено понятие степени окисления. Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов. Степень окисления обозначается арабской цифрой, которую ставят перед символом элемента, со знаком «+» или «−», соответствующим отдаче или приобретению электронов. Степень окисления представляет собой всего лишь удобную форму для учета переноса электронов, ее не следует рассматривать ни как эффективный заряд атома в молекуле (например, в молекуле LiF эффективные заряды Li и F равны соответственно +0,89 и −0,89, тогда как степени окисления +1 и −1), ни как валентность элемента (например в соединениях CH4, CH3OH, HCOOH, CO2 валентность углерода равна 4, а степени окисления соответственно равны −4, −2, +2, +4).
Численные значения валентности и степени окисления могут совпадать по абсолютной величине лишь при образовании соединений с ионной связью. При определении степени окисления используют следующие правила:
1. Атомы элементов, находящихся в свободном состоянии или в виде молекул простых веществ, имеют степень окисления, равную нулю, например Fe, Cu, H2, N2 и т.п.
2. Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона, например,  ,
, 

3. Водород в большинстве соединений имеет степень окисления +1, за исключением гидридов металлов (NaH, LiH), в которых степень окисления водорода равна −1.
Наиболее распространенная степень окисления кислорода в соединениях –2, за исключением пероксидов (Na2O2, Н2О2 – степень окисления кислорода равна −1) и F2O (степень окисления кислорода равна +2).
Для элементов с непостоянной степенью окисления ее значение можно рассчитать, зная формулу соединения и учитывая, что сумма степеней окисления всех атомов в молекуле равна нулю. В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO4, вычисленная исходя из суммарного заряда молекулы [1+x+4(−2)]= 0, х – степень окисления атома хлора), равна +7. Степень окисления атома серы в ионе SO 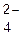 равна +6.
равна +6.
Окислительно-восстановительные свойства элемента зависят от степени его окисления. У атомов одного и того же элемента различают низшую, высшую и промежуточные степени окисления.
Зная степень окисления элемента в соединении, можно предсказать, окислительные или восстановительные свойства это соединение проявляет.
В качестве примера рассмотрим серу S и ее соединения H2S, SO2 и SO3. Связь между электронной структурой атома серы и его окислительно-восстановительными свойствами в этих соединениях наглядно представлена в таблице 7.1.
Таблица 7.1
| Формула вещества | Электронная формула | Окислительно-восстановительные свойства | |
| H2S |  1s22s22p63s23p6
1s22s22p63s23p6
|  – 2 – 2    ; ;  – 6 – 6    ; ;  – 8 – 8    восстановитель
восстановитель
| |
| S |
 1s22s22p63s23p4
1s22s22p63s23p4
|
 + 2 + 2  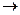  окислитель
окислитель
|  – 4 – 4  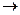  ; ;
 – 6 – 6  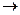  восстановитель
восстановитель
|
| SO2 |  1s22s22p63s23po
1s22s22p63s23po
|  + 4 + 4  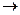  ; ;
 + 6 + 6  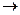  окислитель
окислитель
|
 – 2 – 2  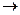  восстановитель
восстановитель
|
| SO3 |  1s22s22p63so3p0
1s22s22p63so3p0
|  + 2 + 2  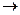  ; ;  + 6 + 6  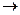  ; ;
 + 8 + 8  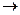  окислитель
окислитель
|
В молекуле H2S атом серы имеет устойчивую октетную конфигурацию внешнего энергетического уровня 3s23p6 и поэтому не может больше присоединять электроны, но может их отдавать.
Состояние атома, в котором он не может больше принимать электроны, называется низшей степенью окисления.
Date: 2015-10-19; view: 458; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |