
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Энергия Гиббса и состояние химического равновесия
Для реакции
АВ(г) «А(г)+ В(г)
энтропийно выгодным будет процесс распада АВ(г) на компоненты (∆S >0), а энергетически выгодным является обратный процесс, который сопровождается понижением энтальпии химической системы (∆H <0), т.е. выделением теплоты.
На каждую из этих противоположных тенденций влияют и природа веществ, и условия проведения реакции.
Учитывает эти противоположные тенденции предложенная американским физико-химиком Д. Гиббсом функция состояния, которая называется энергией Гиббса:
G = H − TS, (3.14)
∆G=∆H − T∆S. (3.15)
Произведение энтропии и температуры (T∆S) определяет величину “связанной” энергии, т.е. ту часть энергии (энтальпии) системы, которую невозможно перевести в работу. Разница между «энергосодержанием» системы (Н) и «связанной» энергией дает долю энергии, которую можно в принципе перевести в работу.
Энергия Гиббса определяет работоспособность системы. При обратимом и изотермическом проведении процесса DG равно по абсолютной величине, но обратно по знаку максимально полезной работе (А max), которую система может произвести в данном процессе:
∆G р=− А max.
Энергия Гиббса служит критерием самопроизвольного протекания химической реакции при изобарно-изотермических процессах.
Химическая реакция принципиально возможна, если энергия Гиббса уменьшается, т.е. ∆Gр <0.
Знак ∆G указывает на направление реакции.
При ∆G <0 реакция протекает в прямом направлении.
При ∆G> 0 возможен лишь обратный процесс.
При ∆G= 0 все вещества находятся в химическом равновесии и внешне незаметно никаких изменений и процессов в системе.
Из уравнения ∆G = ∆H − T∆S следует:
1) если ∆H <0 и ∆S >0, то всегда ∆G <0, т.е. реакция с выделением теплоты и увеличением степени беспорядка возможна при любых температурах;
2) если ∆H> 0 и ∆S <0, то всегда ∆G >0, т.е. реакция с поглощением теплоты и увеличением степени порядка невозможна ни при каких условиях;
3) во всех остальных случаях (∆H <0, ∆S <0 и ∆H >0, ∆S >0) знак ∆G зависит от соотношения членов ∆H и T∆S. Значения ∆H и ∆S могут быть как положительными, так и отрицательными в разных сочетаниях в разных реакциях. Их рассматривают как энергетический (энтальпийный) и энтропийный факторы, определяющие возможность самопроизвольного протекания реакции. Реакция возможна, только если она сопровождается уменьшением энергии Гиббса.
Если ∆H <0, ∆S <0; в этом случае ∆G < 0 при  , т.е. реакция возможна при сравнительно низкой температуре. При низких температурах значение Т невелико, значит, величина произведения T∆S также невелика, и обычно абсолютное значение ∆H превосходит абсолютное значение T∆S. Поэтому направление большинства реакций, протекающих при низких температурах, определяется знаком ∆H.
, т.е. реакция возможна при сравнительно низкой температуре. При низких температурах значение Т невелико, значит, величина произведения T∆S также невелика, и обычно абсолютное значение ∆H превосходит абсолютное значение T∆S. Поэтому направление большинства реакций, протекающих при низких температурах, определяется знаком ∆H.
Если ∆H >0, ∆S >0, то произведение T∆S будет больше, чем ∆H и определяющим фактором будет знак ∆S. В этом случае ∆G <0 при  , т.е. процесс возможен при сравнительно высокой температуре;
, т.е. процесс возможен при сравнительно высокой температуре;
4) при равенстве ∆ G =0 в системе устанавливается химическое равновесие, которое может смещаться в любую сторону при изменении внешних факторов (температура, давление, концентрации реагирующих веществ).
Энергия Гиббса образования вещества. Величина энергии Гиббса вещества зависит как от природы этого вещества, так и от его количества:
G A=(G oA+ RT ln p A) n A, (3.16)
где G A− энергия Гиббса образования вещества А при его парциальном давлении р А (p А¹1атм ); G oA− энергия Гиббса образования одного моля вещества А при стандартных условиях (р А=1 атм и Т =298 К); n A − число молей вещества А.
Стандартная энергия Гиббса образования вещества DGо298 − изменение энергии Гиббса в реакции образования 1моль вещества из простых веществ, находящихся в устойчивых состояниях при стандартных условиях (р =101,3 кПа и Т =298 К).
Значения ∆G о298 для некоторых веществ приводятся в справочной литературе, размерность − кДж/моль.
Стандартные энергии Гиббса образования простых веществ, находящихся в стандартном состоянии в устойчивой модификации, равны нулю. Например, ∆G о298,Н2(газ) = 0 кДж/моль.
Энергия Гиббса химических реакций. Изменение энергии Гиббса химической реакции при стандартных условиях (р =101,3 кПа и Т =298 К) можно вычислить по уравнению
∆G о298, реакции = ∆H о 298, реакции – T∆S о298, реакции, (3.17)
где ∆H о298,реакции, ∆S о298,реакции − стандартные изменения энтальпии и
энтропии химической реакции, соответственно в кДж и Дж/К; Т − стандартная температура, равная 298 К.
Поскольку энергия Гиббса является функцией состояния, то ее значение не зависит от пути протекания процесса, а зависит только от исходного и конечного состояний системы. Изменение энергии Гиббса при стандартных условиях (∆G о298, реакции) можно рассчитать, используя стандартные значения энергий Гиббса образования исходных веществ и продуктов реакции с учетом стехиометрических коэффициентов:
∆G о298,реакции = 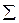 ∆G о298, продукты реакции –
∆G о298, продукты реакции – 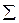 ∆ G о298, исходные вещества. (3.18)
∆ G о298, исходные вещества. (3.18)
Изменение энергии Гиббса ∆G Т для реакции, протекающей при температуре, отличной от стандартной (Т 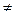 298 К), может быть рассчитано с достаточной для практических целей точностью, используя стандартные значения изменений энтальпии (∆H ореакции) и энтропии (∆S ореакции ) реакции и пренебрегая их зависимостью от температуры:
298 К), может быть рассчитано с достаточной для практических целей точностью, используя стандартные значения изменений энтальпии (∆H ореакции) и энтропии (∆S ореакции ) реакции и пренебрегая их зависимостью от температуры:
∆G Т = ∆H ореакции – T∆ Sореакции. (3.19)
Date: 2015-10-19; view: 482; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |