
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Механизмы химических реакций
Все реакции можно подразделить на простые и сложные. Простые протекают в одну стадию и называются одностадийными. Сложные реакции либо идут последовательно (многостадийные реакции), либо параллельно, либо последовательно – параллельно.
Реакции идут по стадиям. Невозможно представить себе, что в реакции образования аммиака N2 + 3H2 = 2NH3 одновременно столкнутся в одной точке пространства 4 молекулы, да еще нужного сорта.
Количество частиц, принимающих участие в элементарном акте химического превращения называется молекулярностью реакции. Реакции могут быть моно-, би- и тримолекулярными (не больше).
Мономолекулярные – реакции разложения и внутримолекулярные перегруппировки: (J2) = 2(J)
Бимолекулярные: 2NO2 = N2O4
Тримолекулярные (редкие): 2NO + O2 = 2NO2.
В этих примерах порядок и молекулярность совпадают, но в общем случае они различны.
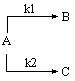
Последовательные реакции.
Последовательными называют реакции с промежуточными стадиями, когда продукт предыдущей стадии служит исходным веществом для последующей:
k1 k2
А à B à C.
При k1>>k2 все исходное вещество может превратиться в промежуточный продукт В, прежде чем начнется вторая реакция. Скорость всей реакции определяется второй стадией. При k1<<k2 концентрация промежуточного продукта мала, поскольку он не успевает накапливаться; эта стадия определяет скорость реакции в целом. Таким образом, скорость определяется самой медленной стадией (принцип лимитирующей стадии).
Параллельные реакции.
Реакции, в которых исходные вещества способны образовывать разные продукты реакции, называются параллельными.
 |
Например, разложение гидразина:
N2H4àN2+2H2
3N2H4à4NH3+N2
В этом случае суммарная скорость реакции разложения гидразина равна сумме скоростей по тому и другому пути.
Сопряженные реакции – реакции, в которых с одними тем же веществом взаимодействуют два и более веществ.
A+BàAB
A+D=AD
Колебательные реакции.
В последние годы уделяется большое внимание периодическим процессам, характеризующимися колебаниями концентраций некоторых промежуточных соединений и соответственно скоростями превращения – такие реакции называют колебательными. Наблюдаются такие процессы в газовой и жидкой фазах и особенно часто на границе раздела этих фаз с твердой фазой. Колебательными чаще всего бывают окислительно - восстановительные реакции, а также реакции, сопровождающиеся появлением новой фазы вещества. Причиной возникновения колебаний концентрации является наличие обратных связей между отдельными стадиями сложной реакции.
Пример: реакция, открытая Б.П.Белоусовым – взаимодействие лимонной кислотой с броматом, ускоряемое ионами церия. Раствор регулярно изменяет краску от бесцветного катализатора (Ce III) к желтому (Ce IV) и обратно. Эти процессы объясняются на основе термодинамики необратимых процессов, крупный вклад в развитие теории колебательных реакций внес И.Р.Пригожин.
Date: 2015-10-19; view: 308; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |