
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Цель, задачи и методологические принципы физико-химического анализа
Фазовое равновесие является состоянием термодинамического равновесия в гетерогенной физико-химической системе, к которому самопроизвольно эволюционируют все другие состояния. Поэтому теоретической основой представлений о фазовых равновесиях является учение о термодинамическом равновесии в термодинамике равновесных процессов.
Изучение фазовых равновесий в физико-химических системах осуществляетсяс помощью физико-химического анализа. По определению его создателя, выдающегося российского ученого, академика Николая Семеновича Курнакова (1860 - 1941), физико-химический анализ - отдел общей и физической химии, цель которого состоит в поиске закономерностей в соотношениях между составом и свойствами равновесных систем, а результатом которого является построение графического образа этих закономерностей – фазовых диаграмм или диаграмм "состав—свойство".
Н.С. Курнаковым сформулированы методологические принципы физико-химического анализа: принцип соответствия и принцип непрерывности [1].
Принцип соответствия формулируется так: каждому комплексу сосуществующих фаз в физико-химической системе отвечает вполне определенный геометрический образ на диаграмме состояния.
Принцип непрерывности. Согласно этому принципу при непрерывном изменении параметров, определяющих состояние системы, свойства отдельных фаз изменяются непрерывно. Так, при непрерывном изменении состава твердых или жидких растворов их свойства (например, удельная электропроводность, вязкость, температура плавления и др.) изменяются непрерывно.
В семидесятых годах ХХ века профессором Я.Г. Горощенко [2] был сформулирован третий принцип физико-химического анализа – принцип совместимости: "Любой набор компонентов, независимо от их числа и физико-химических свойств, может составить физико-химическую систему". Одним из следствий принципа совместимости является утверждение о том, чтофазовые диаграммы как геометрические образы фазового пространства могут быть эффективным средством исследования закономерностей фазовых состояний в системах любой природы.
Для определения характера взаимодействия веществ в физико-химическом анализе проводятся исследования различных физических свойств, чувствительных к изменению состава системы. К таким свойствам относятся: температура плавления, теплоемкость, теплоты образования, электропроводность, э. д. с; показатель преломления, спектры поглощения, плотность, коэффициент теплового расширения, твердость, вязкость, поверхностное натяжение, магнитная восприимчивость и т. п.
Физико-химический анализ позволяет установить наличие полиморфных превращений при исследовании однокомпонентных, двойных (бинарных) и более сложных физико-химических систем, природу образующихся фаз и области их существования в зависимости от температуры, состава и давления, а также проанализировать образование метастабильных фаз, устойчивых лишь в ограниченной области температур, давлений и соотношений компонентов.
Результатом физико-химического анализа является фазовая диаграмма состояния - графический образ всех достижимых состояний в физико-химической системе. Фазовая диаграмма является той теоретической основой, без которой невозможно создание полноценной технологии получения вещества с наперед заданными свойствами.
2.2. Фазовые равновесия в однокомпонентной системе. Уравнение Клаузиуса – Клапейрона. Р-Т-V диаграмма.
В связи с постоянством состава однокомпонентной системы химический потенциал индивидуального вещества совпадает с мольной энергией Гиббса μ =  . В однокомпонентной системе условием равновесия между двумя фазами при постоянных давлении и температуре является равенство мольных энергий Гиббса в сосуществующих фазах:
. В однокомпонентной системе условием равновесия между двумя фазами при постоянных давлении и температуре является равенство мольных энергий Гиббса в сосуществующих фазах:
 (2.1)
(2.1)
или
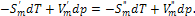 (2.2)
(2.2)
Откуда получаем уравнение Клапейрона
 , (2.3)
, (2.3)
где  - мольная энтальпия равновесного фазового перехода, а
- мольная энтальпия равновесного фазового перехода, а  - разность мольных объемов фаз, находящихся в равновесии.
- разность мольных объемов фаз, находящихся в равновесии.
Для процессов испарения и возгонки выражение (2.3) можно преобразовать, считая, что мольный объем конденсированных фаз значительно меньше мольного объема пара: Vконд.≪ Vпар. Подставляя (Vпар- Vконд.) ≈ Vпар = RT/p, получаем уравнение Клаузиуса – Клапейрона:
 , (2.4)
, (2.4)
и после преобразования
 (2,5)
(2,5)
Интегрирование в предположении, что ∆Н ф.п. не зависит от температуры, дает
ln p = -  C. (2.6)
C. (2.6)
Следовательно, зависимость ln p от 1/T должна быть линейной, а ее наклон равен - 

Рисунок 2.1. Общий вид P-T-V диаграммы и ее проекций для однокомпонентной системы
Однако более наглядно состояния однокомпонентной системы можно представить объемной Р-Т-V диаграммой и ее Р-Т, T-V и P-V проекциями (рис.2.1).

Рисунок 2.2. Схема фазовых равновесий на P-T – фазовой диаграмме
однокомпонентной системы.
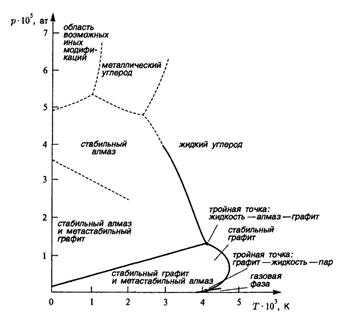
Рисунок 2.3. P-T – диаграмма углерода
На рис. 2.2 показана общая схема Р-Т проекции диаграммы состояния и обозначены области однофазных (S,G, Lq), линии двухфазных и точки трехфазных равновесий. Для иллюстрации на рис 2.3 представлена P-T проекция реальной фазовой диаграммы углерода, позволяющая определить параметры равновесия его полиморфных модификаций.
Контрольные вопросы
1. Определите, что представляет собой физико-химический анализ? Является ли эта область знания методом анализа? Сформулируйте его цели и задачи.
2. Сформулируйте принцип непрерывности и поясните его смысл на примере.
3. Дайте определение принципа соответствия.
4. Какую роль в физико-химическом анализе играет принцип сочетаемости?
5. Запишите условия и возможные варианты фазовых равновесий для однокомпонентной системы и поясните на рисунке 2.1.
6. Какое значение имеют уравнения Клапейрона и Клапейрона - Клаузиуса для количественной оценки фазовых равновесий в однокомпонентных системах (рисунок 2.2)?
3.1. Фазовые равновесия в двухкомпонентных системах. Зависимость энергии Гиббса от состава. 3.2.Твердые растворы: условия их образования и распада.
Date: 2015-10-18; view: 1251; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |