
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Кислоты тон
Для удобства часто вместо Ка используют рКа= ¾ lg Ка
Кислотность различных классов органических соединений с одинаковыми радикалами увеличивается в следующей последовательности:
| R – H2С – H Алканы | R-NH-H Амины | R-O-H Спирты | R-S-H Тиолы | 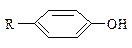 Фенолы
Фенолы
| R – СOOH Карбоновые кислоты |
| рКа 50 | рКа 30 | рКа 18 | рКа 12 | pКа 10 | рКа 4,7 |
| СН кислоты | NH кислоты | ОН кислоты | SH кислоты | ОН кислоты | ОН кислоты |
Причиной самой слабой кислотности С-Н кислот является то, что углерод обладает низкой электроотрицательностью и проявляет слабую способность удерживать отрицательный заряд на анионе. Поэтому образование карбанионов является энергетически невыгодным процессом:
СН4  СН3 ˉ + Н+
СН3 ˉ + Н+
карбанион
(метил-анион)
Среди насыщенных соединений заметную кислотность проявляют спирты (О-Н-кислоты), что обусловлено достаточной электроотрицательностью атома кислорода, т.е. способностью удерживать электронную пару в анионе, тем самым, стабилизируя его:
R¾O¾H  R¾Oˉ + H+
R¾Oˉ + H+
спирт алкоксид-
анион
Стабильность аниона R – Oˉ значительно повышается с появлением возможности делокализации отрицательного заряда либо за счет электроотрицательного элемента в радикале, либо по системе сопряженных связей. Так, например, увеличение кислотности нарколана (Br3C–CH2-OH) объясняется влиянием –I эффекта трех атомов брома в радикале (стабилизирующий фактор).
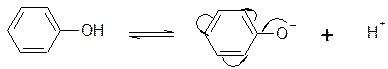 |
Увеличение кислотности фенолов по сравнению с алифатическими спиртами объясняется стабильностью фенолят-аниона, отрицательный заряд которого делокализуется по ароматическому кольцу вследствие +М эффекта.
Br3C–CH2-OH 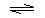 Br3CCH2O¾ + H+
Br3CCH2O¾ + H+
Тиолы проявляют более сильные кислотные свойства по сравнению со спиртами благодаря большему размеру атома серы, в котором отрицательный заряд лучше делокализуется, стабилизируя тиолят-анион.
Карбоновые кислоты в данном ряду – самые сильные кислоты.
Это объясняется образованием стабильного карбоксилат-аниона при диссоциации карбоновых кислот. Карбоксилат-анион стабилизирован за счет делокализации отрицательного заряда по системе сопряжения:
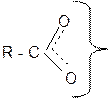 |
(¾)
Изменение основности будет противоположно изменению кислотности. Чем выше основность, тем ниже кислотность.
Спирты
Производные углеводородов, в которых один или несколько атомов водорода замещены на ОН-группы, называют спиртами. Общая формула R-O-H.
Классификация:
1) по атомности – по количеству ОН-групп на одно- и многоатомные спирты;
2)по характеру радикала – предельные и непредельные; алифатические и ароматические;
3) по характеру атома углерода, с которым связана ОН-группа, – первичные, вторичные, третичные спирты.
Date: 2015-10-22; view: 379; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |