
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Химическое равновесие
В обратимых химических процессах типа
аА+вВ 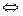 сС+dD
сС+dD
наряду с прямой реакцией протекает обратная реакция. В момент равновесия скорости прямой и обратной реакций уравниваются, после чего концентрации участвующих в процессе веществ остаются неизменными.
Самопроизвольно реакция идет в сторону уменьшения свободной энергии Гиббса  ; в состоянии равновесия
; в состоянии равновесия  равна 0.
равна 0.
Изменение энергии Гиббса связано с исходными и равновесными концентрациями через уравнение Гиббса:

где A0, B0, C0, D0 – начальные концентрации веществ,
A, B, C, D – равновесные концентрации,
a, b, c, d – стехиометрические коэффициенты,
a – активности веществ.
Если исходные концентрации всех веществ равны 1,


К – константа равновесия.
Константа равновесия дает соотношение между концентрациями (или парциальными давлениями) реагирующих веществ в состоянии равновесия.
Термодинамическая константа равновесия Кр связана с энергией Гиббса следующим образом
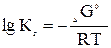
 реакции = Σ
реакции = Σ  конечных прод. - Σ
конечных прод. - Σ  исходных веществ
исходных веществ
 =
=  , где
, где
 - изменение энтальпии, тепловой эффект реакции;
- изменение энтальпии, тепловой эффект реакции;
 - изменение энтропии в результате реакции.
- изменение энтропии в результате реакции.
Изменение их в ходе реакции аналогично изменению  :
:
 р = Σ
р = Σ  прод. реакции - Σ
прод. реакции - Σ  исходных веществ
исходных веществ
 р = Σ
р = Σ  прод. реакции - Σ
прод. реакции - Σ  исходных веществ
исходных веществ
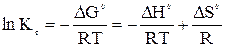
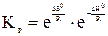
Для экзотермических реакций  <0, с повышением температуры К р снижается; если реакция эндотермическая,
<0, с повышением температуры К р снижается; если реакция эндотермическая,  <0, с повышением температуры К р увеличивается.
<0, с повышением температуры К р увеличивается.
Константу равновесия, помимо термодинамических, можно рассчитывать из экспериментальных данных. Для этого нужно определить концентрации всех компонентов смеси в состоянии равновесия.
В зависимости от того, в каких единицах выражаются концентрации компонентов идеальной системы, различают
 - константа, выраженная через парциальные давления компонентов.
- константа, выраженная через парциальные давления компонентов.
 - константа, выраженная через равновесные концентрации компонентов.
- константа, выраженная через равновесные концентрации компонентов.
 - константа, выраженная через равновесные мольные доли компонентов в состоянии равновесия.
- константа, выраженная через равновесные мольные доли компонентов в состоянии равновесия.
Для идеальных газов  и
и  ,
,
где Р – общее давление, поэтому
 ,
,
где  - изменение числа молей в реакции:
- изменение числа молей в реакции:  =c+d-(a+b).
=c+d-(a+b).
Зная константу равновесия, можно рассчитать степень превращения исходных веществ, что имеет большее значение для химико-технологических процессов.
Примеры расчетов:
1. Рассчитать константу равновесия реакции:

при давлении 1атм, отношении бензол: э тилен, равном 1:1, если степень конверсии бензола составляет 60%.
Рассчитать состав равновесной смеси в мольных долях:
| исходная смесь, моль | вст. в реакцию, моль | равн. смесь, моль | равн. смесь, мол. доля | |
| бензол | 0,6 | 0,4 | 0,286 | |
| этилен | 0,6 | 0,4 | 0,286 | |
| этилбензол | 0,6 | 0,428 | ||
| Итого | 1,4 | 1,000 |

2. В реакцию конверсии оксида углерода с водяным паром

взято 0,4 моля СО и 0,6 моля паров воды. Равновесное количество водорода составило 0,26 моля. Рассчитать константу равновесия Кр.
Рассчитываем состав равновесной смеси:
| исх. конц, моль | равн. конц., моль | |
| СО | 0,4 | 0,14=0,4-0,26 |
| Н2О | 0,6 | 0,34=0,6-0,26 |
| СО2 | 0,26 | |
| Н2 | 0,26 |

3. Рассчитать константу равновесия реакции

при температуре 500К из термодинамических данных:
 образ., кДж/моль образ., кДж/моль
|  образ, Дж/мольК образ, Дж/мольК
| |
| Изопропилбензол | -12,980 | 489,9 |
| Бензол | 73,423 | 325,5 |
| пропилен | 11,694 | 307,6 |
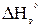 = -12980 -73423 -11694 =-98097Дж/моль
= -12980 -73423 -11694 =-98097Дж/моль
 =489,9 -325,5 -307,6 =-143,2Дж/мольК
=489,9 -325,5 -307,6 =-143,2Дж/мольК
 = -98097 -500(-143,2) =-26497Дж
= -98097 -500(-143,2) =-26497Дж

4. Рассчитать тепловой эффект реакции в интервале температур 1100-1200К
СН3-СН3↔СН2=СН2+Н2
если свободная энергия образования  равна (кДж/моль)
равна (кДж/моль)
| К | Этан | Этилен |
| 130,97 | 126,28 | |
| 152,62 | 134,36 |
 1100К = 126280-130970=-4690Дж/моль
1100К = 126280-130970=-4690Дж/моль
 1200К = 134360-152620=-18260Дж/моль
1200К = 134360-152620=-18260Дж/моль
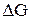 1100 =
1100 =  -1100
-1100 
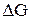 1200 =
1200 =  -1200
-1200 
Считая  постоянным в интервале температур 1100-1200К
постоянным в интервале температур 1100-1200К
 1100 - 1100
1100 - 1100  =
=  1200 - 1200
1200 - 1200  , откуда
, откуда

 = -18260+1200(-135,7)=144580Дж/моль
= -18260+1200(-135,7)=144580Дж/моль
Можно рассчитать  по двум константам при 1100 и 1200К.
по двум константам при 1100 и 1200К.

5. Константа равновесия реакции при температуре 1100К равна 1;
 =-40кДж/моль. При какой температуре константа равновесия будет равна 10?
=-40кДж/моль. При какой температуре константа равновесия будет равна 10?

6. Константа химического равновесия Кр реакции
изо - С3Н7ОН ↔ СН3СОСН3+Н2
при 3270С равна 17,6. Чему равен выход ацетона при давлении 0,15МПа?
Рассчитываем равновесный состав смеси:
| В-во | исх. конц | прореаг. | кон. смесь | Состав в мольных долях |
| i-С3Н7ОН | х | 1-х | 
| |
| СН3СОСН3 | х | 
| ||
| Н2 | х | 
| ||
| Итого | 1+х |


х=96%
7. Значение логарифмов констант равновесия образования из элементов для Н-бутана и изобутана равны:
| Т, к | lg Kp | |
| Н-С4Н10 | изо С4Н10 | |
| 2,869 | 3,518 | |
| -2,784 | -2,500 | |
| -6,358 | -6,291 | |
| -8,881 | -8,917 |
Определить зависимость возможной глубины реакции от температуры и тепловой эффект реакции.
Рассчитываем константы равновесия при заданных температурах.


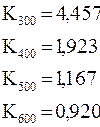
Реакция идет без изменения числа молей:

х300=0,817
х400=0,658
х500=0,539
х600=0,479
Рассчитываем тепловой эффект реакции в интервале 300 – 600К:

Date: 2015-10-22; view: 672; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |