
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Номенклатура ферментов
1) Существует тривиальная номенклатура – названия случайные, без системы и основания, например трипсин, пепсин, химотрипсин.
2) Рабочая номенклатура – название фермента составляется из названия субстрата или продукта реакции, типа катализируемой реакции и окончание –аза, например лактатдегирогеназа.
3) Систематическая, научная - L-лактат-НАД-оксидредуктаза.
4) Все ферменты имеют цифровой шифр, например ЛДГ - 1.1.1.27.
Первая цифра говорит о типе катализируемой реакции, указывая на номер класса.
Вторая уточняет действие фермента – номер подкласса.
Третья указывает природу разрываемой связи в молекуле субстрата - подподкласс.
Четвёртая – порядковый номер фермента
Выделяют несколько видов специфичности:
а) абсолютная специфичность. Фермент действует только на один единственный субстрат. Пр.: уреаза разрушает мочевину: NH2-CO-NH2® (над стрелкой уреаза, под – вода) 2NH3+ CO2. Аргиназа катализирует распад аргинина.
б) групповая специфичность. Фермент действует на определённую связь в разных субстратах. Пр.: пептидазы разрывают пептидные связи [-NH-CH(R)-CO--NH-CH(R)-CO-]. Пепсин действует только на связи, образованные карбоксильной группой ароматических АК (ФЕН, ТИР, ТРИ). Эстеразы разрывают сложно-эфирную связь [-CO-NH-] в различных липидах. Гликозидазы действуют на гликозидную связь. Действие ферментов, обладающих групповой специфичностью, позволяет организму содержать небольшое количество ферментов.
в) стереоспецифичность. Фермент действует на определённый стереоизомер (D- и L-, цис- и транс-). Пр.: бутен-2-диовая кислота имеет 2 стереоизомера: транс-изомер или фумаровая к-та, и цис-изомер или малеиновая кислота.

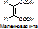
Фумараза действует на фумаровую к-ту с превращением последней в яблочную.
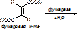
В стереоспецифичности выделяют оптическую специфичность – избирательное действие ферментов на оптические изомеры. Например, под действием ЛДГ разрушается только L-форма молочной к-ты.

3) Влияние температуры (правило Вант-Гоффа). При увеличении температуры на 10 градусов скорость реакции увеличивается в 1,5-2 раза. Но для фермента это правило действует только до 40 градусов, т.к. дальше наступает тепловая денатурация фермента. Большинство ферментов в организме человека имеет оптимальную температуру 25-40 градусов [рис. графика: по оси х – температура, по у – процент активности. Рисуем горочку, оптимум – на 37-40°С].
Повышение активности фермента при увеличении температуры объясняется увеличением кинетической энергии реагирующих молекул, что приводит к увеличению числа столкновений между молекулами. При дальнейшем повышении температуры энергия становится чрезмерной, и внутри молекулы разрываются слабые связи – водородные, гидрофильные взаимодействия; происходит нарушение вторичной, третичной, четвертичной структуры фермента.
Ряд ферментов термостабильны, например, гликопротеины.
4) Влияние рН. Для поддержания третичной или четвертичной структуры фермента часто может быть необходимо наличие заряда на группе, удаленной от области связывания субстрата. Если же заряд этой группы меняется, то может происходить частичное развертывание белковой цепи, или компактизация, или диссоциация (олигомерные белки). Поэтому при отклонении рН от оптимального значения, фермент может потерять свою нативную структуру, в результате чего не происходит полноценного связывания активного центра с субстратом. Также при изменении рН может происходить изменение заряда на субстрате.
[рис. график. По х – рН, по у – процент активности. Рисуем горочку.]
Пепсин – 1.5-2, амилаза слюны - 6.8-7.2, трипсин - 7.5-8.6. Для большинства ферментов оптимум рН лежит в среде, близкой к нейтральной.
5) Скорость ферментативной реакции прямо пропорциональна кол-ву фермента (для небиологических катализаторов такой зависимости нет). Недостаток фермента в живом организме, например при неполноценном питании, генетических нарушениях, приводит к уменьшению скорости превращения веществ и наоборот.
6) Ферменты являются регулируемыми катализаторами. Так под действием различных веществ (активаторов и ингибиторов) меняется скорость ферментативной реакции.
Ингибирование ферментов. Ингибитор – это вещество, вызывающее специфическое снижение активности фермента. Следует различать ингибирование и инактивацию. Инактивация – это, например, денатурация белка в результате действия денатурирующих агентов.
По прочности связывания ингибитора с ферментом ингибиторы делят на обратимые и необратимые.
Необратимые ингибиторы прочно связаны и разрушают функциональные группы молекулы фермента, которые необходимы для проявления его каталитической активности. Все процедуры по очистке белка не влияют на связь ингибитора и фермента. Пр.: действие фосфорорганических соединений на фермент – холинэстеразу. Хлорофос, зарин, зоман и др. фосфорорганические соединения связываются с активным центром холинэстеразы. В результате происходит фосфорилирование каталитических групп активного центра фермента. В следствии молекулы фермента, связанные с ингибитором, не могут связываться с субстратом и наступает тяжелое отравление.
Также выделяют обратимые игнибиторы, например прозерин для холинэстеразы. Обратимое ингибирование зависит от концентрации субстрата и ингибитора и снимается избытком субстрата.
По механизму действия выделяют:
- конкурентное ингибирование;
- неконкурентное ингибирование;
- субстратное ингибирование;
- аллостерическое.
1) Конкурентное (изостерическое) ингибирование – это торможение ферментативной реакции, вызванное связыванием ингибитора с активным центром фермента. При этом ингибитор имеет сходство с субстратом. В процессе происходит конкуренция за активный центр: образуются фермент-субстратные и ингибитор-ферментные комплексы. E+S®ES® EP® E+P; E+I® E. Пр.: сукцинатдегидрогеназная реакция [рис. COOH-CH2-CH2-COOH®(над стрелкой СДГ, под ФАД®ФАДН2) COOH-CH=CH-COOH]. Истинным субстратом этой реакции является сукцинат (янтарная к-та). Ингибиторы: малоновая к-та (COOH-CH2-COOH) и оксалоацетат (COOH-CO-CH2-COOH). [рис. фермента с 3 дырками+ субстрат+ ингибитор= комплекс ингибитора с ферментом]
Пр.: фермент холинэстераза катализирует превращение ацетилхолина в холин: (CH3)3-N-CH2-CH2-O-CO-CH3® (над стрелкой ХЭ, под – вода) CH3СOOH+(CH3)3-N-CH2-CH2-OH. Конкурентными ингибиторами являются прозерин, севин.
2) Неконкурентное ингибирование – торможение, связанное с влиянием ингибитора на каталитическое превращение, но не на связывание фермента с субстратом. В этом случае ингибитор может связываться и с активным центром (каталитический участок) и вне его.
Присоединение ингибитора вне активного центра приводит к изменению конформации (третичной структуры) белка, вследствие чего изменяется конформация активного центра. Это затрагивает каталитический участок и мешает взаимодействию субстрата с активным центром. При этом ингибитор не имеет сходства с субстратом и это ингибирование нельзя снять избытком субстрата. Возможно образование тройных комплексов фермент-ингибитор-субстрат. Скорость такой реакции не будет максимальной.
К неконкурентным ингибиторам относят:
- цианиды. Они связываются с атомом железа в цитохромоксидазе и в результате этого фермент теряет свою активность, а т.к. это фермент дыхательной цепи, то нарушается дыхание клеток и они гибнут.
- ионы тяжёлых металлов и их органические соединения (Hg, Pb и др.). Механизм их действия связан с соединением их с различными SH-группами. [рис. фермента с SH-группами, иона ртути, субстрата. Все это соединяется в тройной комплекс]
- ряд фармакологических средств, которые должны поражать ферменты злокачественных клеток. Сюда же относятся ингибиторы, использующиеся в сельском хозяйстве, бытовые отравляющие вещества.
3) Субстратное ингибирование – торможение ферментативной реакции, вызванное избытком субстрата. Происходит в результате образования фермент-субстратного комплекса, неспособного подвергаться каталитическому превращению. Его можно снять и уменьшить концентрацию субстрата. [рис. связывания фермента сразу с 2 субстратами]
4) Аллостерическое ингибирование – торможение ферментативной реакции, вызванное присоединением аллостерического ингибитора в аллостерическом центре аллостерического фермента. Такой тип ингибирования характерен для аллостерических ферментов, имеющих четвертичную структуру. В качестве ингибиторов могут выступать метаболиты, гормоны, ионы металлов, коферменты.
Механизм действия:
а) присоединение ингибитора к аллостерическому центру;
б) изменяется конформация фермента;
в) изменяется конформация активного центра;
г) нарушается комплиментарность активного центра фермента к субстрату;
д) уменьшается число молекул ES;
е) уменьшается скорость ферментативной реакции.
[рис. фермент с 2 дырками, к одной аллостерический ингибитор и вторая меняет форму]
К особенностям аллостерических ферментов относят ингибирование по отрицателтной обратной связи. A®(E1)B®(E2) C®(E3) D (от D стрелочка к стрелке между А и В). D – метаболит, действующий как аллостерический ингибитор на фермент Е1.
Date: 2015-09-25; view: 704; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |