
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Решение. 1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl .Такие соли гидролизу не подвергаются
1. Хлорид калия KCl – соль, образованная сильным основанием KOH и сильной кислотой HCl.Такие соли гидролизу не подвергаются, рН водного раствора =7.
2. Карбонат натрия Na2CO3 - соль, образованная сильным основанием NaOH и слабой кислотой H2CO3. Такие соли подвергаются гидролизу по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
СО32- + Н2О ↔ НСО3- + ОН-
Поскольку при гидролизе в свободном виде образуются ионы гидроксила, водный раствор данной соли имеет щелочную среду (рН>7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы Na+, которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
2Na+ + СО32- + Н2О ↔ НСО3- + ОН- + 2Na+
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
Na2СО3 + Н2О ↔ NaНСО3 + NaОН
В результате гидролиза образуется кислая соль NaНСО3.
3. Нитрат марганца Mn(NO3)2 - соль, образованная слабым основанием Mn(OH)2 и сильной кислотой HNO3. Такие соли подвергаются гидролизу по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Mn2+ + H2O ↔MnOH+ + H+
Поскольку при гидролизе в свободном виде образуются ионы водорода, водный раствор данной соли имеет кислую среду (рН< 7).
Для записи полной ионной формы уравнения следует добавить в правую и левую части уравнения ионы NО3-, которые присутствуют в реакционной смеси, но участия в гидролизе не принимают:
2NО3- Mn2+ + H2O ↔MnOH+ + H+ + 2NО3-
Объединив ионы в молекулы, получим молекулярную форму уравнения гидролиза:
Mn(NO3)2 + H2O ↔MnOHNО3 + HNО3
В результате гидролиза образуется основная соль MnOHNО3.
4. Ацетат аммония CH3COONH4 - соль, образованная слабым основанием NН4OH и слабой уксусной кислотой CH3COOH. Такие соли подвергаются гидролизу одновременно по катиону и по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
NH4+ + CH3COO- + H2O ↔ NH4OH + CH3COOH
Поскольку при гидролизе в свободном виде не образуются ни ионы водорода, ни ионы гидроксила водный раствор данной соли имеет близкую к нейтральной среду (рН≈7).
Уравнение гидролиза в молекулярной форме имеет вид:
CH3COONH4 + H2O ↔ NH4OH + CH3COOH
Пример 2. Чему равна степень гидролиза h и значение рН сульфита натрия в растворе концентрации 0,1 моль/л?
Решение. Na2SО3 - соль, образованная сильным основанием NaOH и слабой кислотой H2SО3. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
SО32- + Н2О ↔ НSО3- + ОН-
х х
Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле:
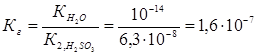
В соответствии с уравнением реакции 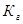 можно выразить через равновесные концентрации ионов:
можно выразить через равновесные концентрации ионов: 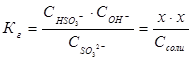 ; отсюда
; отсюда 
Степень гидролиза h показывает долю прогидролизовавшихся молекул и рассчитывается по формуле: 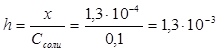 ;
;

Пример 3. Вычислите константу гидролиза и степeнь гидролиза раствора сульфата хрома Cr2(SO4)3, рН которого равен 3.
Решение. Cr2(SO4)3 - соль, образованная слабым основанием Cr(OH)3 и сильной кислотой H2SО4. Гидролиз протекает по катиону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Cr3+ + H2O ↔ CrOH2+ + H+
Х Х
Константа гидролиза Кг рассчитывается с использованием справочных данных по формуле:
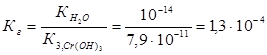
Вычислим концентрацию ионов водорода, исходя из значения рН = -lg 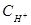 , отсюда
, отсюда 

 . В соответствии с уравнением реакции
. В соответствии с уравнением реакции 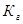 можно выразить через равновесные концентрации ионов:
можно выразить через равновесные концентрации ионов: 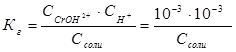 , отсюда
, отсюда  = 0,77 .10-2Степень гидролиза h показывает долю прогидролизовавшихся молекул и рассчитывается по формуле:
= 0,77 .10-2Степень гидролиза h показывает долю прогидролизовавшихся молекул и рассчитывается по формуле: 

Пример 4. Вычислите константу диссоциации селенистоводородной кислоты Н2Se, если рН 0,05 М раствора Na2Se, равен 11,85.
Решение. Na2Sе - соль, образованная сильным основанием NaOH и слабой кислотой H2Sе. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
Sе2- + Н2О ↔ НSе- + ОН-
х х
Вычислим концентрацию ионов водорода, исходя из значения рН = -lg 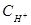 , отсюда
, отсюда 

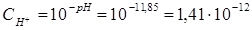 . Вычислим концентрацию ионов ОН:
. Вычислим концентрацию ионов ОН:  . В соответствии с уравнением реакции
. В соответствии с уравнением реакции 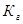 можно выразить через равновесные концентрации ионов:
можно выразить через равновесные концентрации ионов: 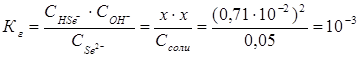 .
.
Константа гидролиза Кг рассчитывается по формуле: 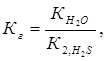 отсюда
отсюда 
Пример 5. Вычислите константы гидролиза раствора хромата калия К2CrO4 и напишите уравнения гидролиза. По какой ступени гидролиз протекает в большей степени?
Решение. К2CrO4- соль, образованная сильным основанием КOH и слабой кислотой H2CrO4. Гидролиз протекает по аниону, в сокращенной ионной форме уравнение гидролиза запишется следующим образом:
1-ая ступень: CrO42- + Н2О ↔ НCrO4- + ОН-
2К+ + CrO42- + Н2О↔ НCrO4- + ОН- + 2К+
К2CrO4 + Н2О ↔ КНCrO4 + КОН
Константа гидролиза К1,г рассчитывается по формуле: 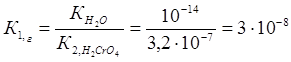
2-ая ступень: НCrO4- + Н2О ↔ Н2CrO4 + ОН-
К+ + НCrO4- + Н2О ↔ Н2CrO4 + ОН- + К+
КНCrO4 + Н2О ↔ Н2CrO4 + КОН
Константа гидролиза К2,г рассчитывается по формуле: 
Так как К1,г˃ К2,г, то гидролиз по второй ступени практически не протекает.
12. ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Окислительно-восстановительные реакции (ОВР) имеют большое значение в теории и практике. С ними связаны процессы: дыхание, обмен веществ, фотосинтез, гниение, горение, электролиз, коррозия металлов и др.
ОВР называются реакции, протекающие с изменением степени окисления атомов, входящих в состав реагирующих веществ.
Степень окисления (зарядность, окислительное число) – это условный заряд, который приобрел бы атом элемента, если предположить, что он принял или отдал то или иное число электронов.
Повышение или понижение степени окисления атомов отражается в электронных уравнениях.
Окислитель принимает электроны. Процесс приема электронов называется восстановлением, например:
Mn6+ + 2e- ® Mn4+,
Мn6+ - окислитель, в процессе реакции восстанавливается до Mn4+.
Восстановитель отдает электроны. Процесс отдачи электронов называется окислением, например:
Zn0 – 2e- ® Zn2+,
Zn0 – восстановитель, в процессе реакции окисляется до Zn2+.
Степень окисления может иметь нулевое, отрицательное, положительное значения.
При определении степени окисления следует знать несколько основных положений:
(-2) - степень окисления атома кислорода в соединениях:
H2+O-2, Cu+2O-2 (исключение: пероксиды: H2 +O2 -1, Na2O2-1, CaO2-1; супероксиды (надперекиси): KO2-1/2, CsO2-1/2; фторид кислорода O+2F2 -).
(-1) - степень окисления фтора в соединениях: H+F-, Са+2F2-.
(0) - нулевую степень окисления имеют атомы в молекулах простых веществ и свободные металлы: H20, O20, Cl20, Zn0, Cu0 и др.
(+1) - степень окисления щелочных металлов (I А погруппа): Na+Cl-, K+Br- и др.
(+2) - степень окисления щелочноземельных металлов (II А подгруппа): Сa+2Cl2-, Ba+2O-2 и др.
Используя эти данные, можно вычислять степени окисления других атомов в соединениях, зная, что алгебраическая сумма степеней окисления всех атомов, входящих в молекулу, равна нулю.
Date: 2015-09-25; view: 612; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |