
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Электродные потенциалы
Потенциал Е электрода рассчитывают по формуле Нернста:
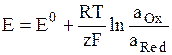 (3)
(3)
где аOx и aRed – активности окисленной и восстановленной форм вещества, участвующего в электродной реакции, Е0 – стандартный потенциал электрода (при аOx = aRed = 1), R – газовая постоянная, Т – абсолютная температура. При 298 К:
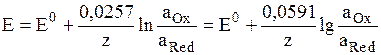 (4)
(4)
Соответственно, стандартная ЭДС гальванического элемента равна разности стандартных потенциалов
∆Е0 = Е0К – Е0А (5)
и связана со стандартной ∆G0 протекающей в нем химической реакции
∆G0 = -zF∆E0. (6)
Абсолютное значение электродного потенциала определить невозможно. На практике измеряют разность потенциалов исследуемого электрода и некоторого стандартного электрода сравнения. Стандартные электродные потенциалы измеряют в условиях, когда активности всех участников реакции, протекающей на исследуемом электроде, равны единице, а давления газа (для газовых электродов) равно 105 Па (1 бар). Для водных растворов в качестве электрода сравнения используют стандартный водородный электрод, потенциал которого при всех температурах принят равным нулю. Стандартный электродный потенциал Е0 электрода равен стандартной ЭДС электрохимической цепи, составленной из исследуемого электрода и стандартного водородного электрода. При схематическом изображении такой цепи водородный электрод записывают слева, а исследуемый электрод справа. Например, стандартные водородные потенциалы цинкового и медного электродов определяются как ЭДС цепей
Pt│H2│H+║Zn2+│Zn,
Pt│H2│H+║Сu2+│Cu
и равны Е0(Zn2+/Zn) = -0,760В и Е0(Cu2+/Cu) = 0,340В при 250С.
Значения некоторых стандартных электродных потенциалов приведены в приложении.
Зная значения стандартных потенциалов, можно рассчитать стандартную ЭДС гальванического элемента. Например, для элемента Даниэля-Якоби стандартная ЭДС равна Е0 = Е0(Cu2+/Cu) - Е0(Zn2+/Zn) = 0,337 – (- 0,763) = 1,100В.
Date: 2015-09-24; view: 467; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |