
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Выполнение работы. В мерную колбу вместимостью 100 мл налить точно отмеренный объем исследуемого раствора сульфата железа (II)
В мерную колбу вместимостью 100 мл налить точно отмеренный объем исследуемого раствора сульфата железа (II). Добавить в колбу 10 мл 2 н раствора серной кислоты и до половины колбы дистиллированной воды. Перемешать раствор круговыми движениями колбы, долить воды до метки и еще раз тщательно перемешать приготовленный рабочий раствор.
Наполнить бюретку 0,05 н раствором перманганата калия KMnO4 и установить уровень раствора на нулевое деление бюретки.
Провести ориентировочное титрование рабочего раствора. Для этого взять пипеткой 10 мл раствора из мерной колбы и перенести в коническую колбу для титрования. Затем прибавлять к нему небольшими порциями раствор перманганата калия из бюретки до неисчезающего в течение 30 секунд обесцвечивания титруемого раствора. Первые капли раствора перманганата калия обесцвечиваются довольно медленно. Как только образуется в растворе немного ионов Mn2+, являющихся катализатором для данной реакции, дальнейшее обесцвечивание перманганата до конца титрования происходит почти мгновенно. Провести 3 точных титрования. Результаты не должны отличаться более, чем на 0,05 мл. Взять среднее значение для проведения расчетов.
Данные опыта занести в таблицу 35.1:
Данные опыта и результаты расчетов Таблица 35.1
| № п/п | V (FeSO4) Объем соли железа | V (KMnO4) Объем перманганата калия | Vср (KMnO4) Средний объем перманганата калия |
Требования к результатам опыта:
1. Рассчитать молярную концентрацию эквивалентов раствора соли железа по закону эквивалентов:
Сэк (FeSO4) · V (FeSO4) = Сэк (KMnO4) · V (KMnO4),
откуда 




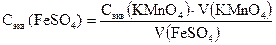

где Сэк (FeSO4) и Cэк (KMnO4) – молярные концентрации эквивалентов растворов; V (FeSO4) и V (KMnO4) − объемы реагирующих растворов.
2. Рассчитать, какому количеству металлического железа соответствует содержание FeSO4 в объеме исследуемого раствора по формуле:
m (Fe) = Mэк (Fe) · Сэк (FeSO4),
где Mэк (Fe) – молярная масса эквивалентов железа.
3. Рассчитать титр раствора FeSO4 по формуле
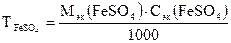 , г/мл
, г/мл
где Мэк (FeSO4) – молярная масса эквивалентов FeSO4; Сэк (FeSO4) – молярная концентрация эквивалентов FeSO4.
Date: 2015-09-24; view: 429; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |