
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Выполнение работы. Опыт 1. Получение и свойства гидроксида меди (II)
Опыт 1. Получение и свойства гидроксида меди (II)
В четыре пробирки налить по 1-2 мл раствора соли меди (II) и во все добавить раствор щёлочи до выпадения осадка. Затем прилить до растворения осадков в первую – раствор HCl, во вторую – раствор аммиака, в третью – концентрированной щёлочи. Содержимое четвёртой пробирки нагреть до кипения и отметить изменение окраски.
Требования к результатам опыта:
1. Написать уравнение реакции получения гидроксида меди (II).
2. Составить уравнения реакций растворения гидроксида меди (II) в:
а) HCl; б) NH4OH; в) концентрированной щелочи.
3. Составить уравнение реакции, происходящей при нагревании Cu(ОН)2.
4. Сделать выводы о кислотно-основных свойствах и термической устойчивости гидроксида меди (II).
Опыт 2. Окислительные свойства соли меди (II)
Налить в пробирку 3-4 мл раствора CuSO4 и прибавить такой же объём раствора KI. Наблюдать образование белого осадка CuI. Дать осадку отстояться и испытать раствор иодкрахмальной бумажкой.
Требования к результатам опыта:
1. Закончить уравнение реакции CuSO4 + KI = и объяснить изменение окраски иодкрахмальной бумажки.
2. Сделать вывод об окислительно-восстановительных свойствах соединений меди (II).
Опыт 3. Получение оксида серебра
В пробирку налить 3-4 капли раствора AgNO3 и добавить 1-2 капли раствора щёлочи. Отметить цвет образующегося осадка.
Требование к результату опыта:
Составить уравнение реакции образования оксида серебра.
Опыт 4. Действие щёлочи на растворы солей металлов подгруппы цинка
Налить в четыре пробирки по 1-2 мл растворов солей цинка, кадмия, ртути (I) и ртути (II). В каждую пробирку по каплям прибавить раствор щёлочи до выпадения осадков. Отметить их цвет. Прилить во все пробирки избыток раствора щёлочи. Какой из осадков растворяется?
Требования к результатам опыта:
1. Составить уравнения реакций взаимодействия вышеперечисленных солей с раствором щелочи.
2. Написать молекулярное и ионные уравнения реакции растворения осадка в избытке щелочи.
Опыт 5. Окислительные свойства солей ртути
В пробирку налить 1-2 мл раствора нитрата ртути (II) и прибавить по каплям раствор SnCl2 до образования белого осадка хлорида ртути (I) Hg2Cl2. К осадку добавить избыток раствора SnCl2. Наблюдать постепенное образование серого осадка металлической ртути.
Требования к результатам опыта:
1. Написать уравнения реакций образования Hg2Cl2 и металлической ртути.
2. Сделать вывод об окислительно-восстановительных свойствах солей ртути (II) и (I).
Опыт 6. Комплексные соединения цинка и кадмия
Налить в одну пробирку 1-2 мл раствора соли цинка, в другую 1-2 мл раствора соли кадмия. В обе пробирки добавить по каплям раствор NH4ОН до образования осадков, а затем до полного их растворения.
Требование к результатам опыта:
Составить молекулярные и ионные уравнения реакций образования гидроксидов и аммиакатов цинка и кадмия.
Задачи
№ 19.1. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Ag → AgNO3 → AgCl → [Ag(NH3)2]Cl → Ag2S
№ 19.2. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
ZnS → ZnO → Zn → ZnSO4 → Zn(OH)2 → Na2ZnO2
№ 19.3. Составить в молекулярном и ионном виде уравнения реакций гидролиза:
а) CuSO4 + H2O ↔; б) CuSO4 + Na2CO3 + H2O =; в) CuCl2 + H2O ↔
№ 19.4. Вычислить ΔН0 реакции восстановления оксида цинка углем с образованием СО. ( -350,6 кДж/моль;
-350,6 кДж/моль; 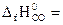 -110,5 кДж/моль).
-110,5 кДж/моль).
(Ответ: 240,1 кДж).
№ 19.5. Написать уравнения реакций, сопровождающихся образованием свободного металла:
а) AgNO3 + H2O2 + NaOH =; б) H[AuCl4] + H2O2 + NaOH =
№ 19.6. Что происходит при действии на гидроксиды цинка и кадмия растворов: а) щелочи; б) аммиака? Написать уравнения соответствующих реакций в молекулярном и ионном виде.
№ 19.7. Вычислить молярную концентрацию водного раствора сульфата меди (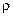 = 1,107 г/мл), полученного при растворении 5 г соли в 45 г воды.
= 1,107 г/мл), полученного при растворении 5 г соли в 45 г воды.
(Ответ: 0,57 моль/л).
№ 19.8. Закончить уравнения реакций: а) CuCl2 + NaOH =;
б) CuO + HNO3 =; в) Cu(СN)2 + КСN =; г) CuSO4 + H2O ↔
№ 19.9. Закончить уравнения реакций: а) Zn + NaNO3 + NaOH =;
б) Zn + K2Cr2O7 + H2SO4 =; в) Hg + HNO3 (разб.) =; г) Zn + H2SO4 (разб.) =
№ 19.10. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
СuS → CuO → Cu → CuSO4 → Cu(OH)2 → CuO
№ 19.11. Можно ли восстановить медь из ее оксида водородом? Ответ мотивировать, вычислив ΔG0 реакции: CuO (к) + H2 (г) = Cu (к) + H2O (г)
(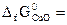 -129,9 кДж/моль;
-129,9 кДж/моль; 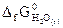 = -228,6 кДж/моль).
= -228,6 кДж/моль).
№ 19.12. Написать уравнения реакций взаимодействия металлов с кислотами: а) Сu + H2SO4 (конц.) =; б) Au + H2SеO4 (конц.) =;
в) Ag + HNO3 (разб.) =; г) Cu + HNO3 (разб.) =
№ 19.13. Кусочек латуни (сплав цинка и меди) растворили в азотной кислоте. Раствор разделили на две части: к одной части прибавили избыток аммиака, а к другой − избыток щелочи. В растворе или в осадке и в виде каких соединений находятся цинк и медь в обоих случаях? Написать уравнения соответствующих реакций.
№ 19.14. С помощью каких химических реакций можно осуществить следующие превращения: HgSO4 → HgO → HgCl2 → HgS → HgO →Hg
№ 19.15. Чему равна молярная масса эквивалентов кадмия, если для выделения 1 г кадмия из раствора его соли надо пропустить через раствор 1717 Кл электричества? (Ответ: 56,2 г/моль).
№ 19.16. Закончить уравнения реакций: а) Hg2Cl2 + SnCl2 =;
б) Cd + HNO3 (разб.) =; в) Cd + H2SO4 (конц.) =; г) Hg + HNO3 (разб.) =
№ 19.17. Составить уравнения реакций, которые надо провести для осуществления следующих превращений:
Cd → Cd(NO3)2 → Cd(OH)2 → [Cd(NH3)4](OH)2 → CdSO4
№ 19.18. Учитывая, что координационное число серебра равно двум, написать уравнения реакций образования комплексных соединений серебра и назвать их:
а) AgNO3 + KCN (избыток) =; б) AgBr + Nа2S2O3 =; в) AgCl + NH4OH =
№ 19.19. Какие вещества образуются при добавлении щелочи к растворам одно- и двухвалентной азотнокислой ртути? Составить молекулярные и ионные уравнения реакций.
№ 19.20. Составить схемы двух гальванических элементов, в одном из которых медь служила бы катодом, а в другом – анодом. Написать уравнения реакций, происходящих при работе этих элементов. Вычислить значения стандартных ЭДС.
Date: 2015-09-24; view: 870; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |