
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Тесты. Электрохимические элементы. Электролиз
Вариант 1
1. Какие факторы определяют значение потенциала электрода
1) концентрация потенциал-определяющих ионов;
2) время контакта электрода с раствором;
3) масса электрода;
4) потенциал электрода сравнения;
5) нет ответа?
2. При контакте какого из перечисленных ниже металлов с водой концентрация свободных электронов на поверхности его будет наибольшей
1) медь; 2) железо; 3) хром; 4) магний; 5) золото?
3. Вычислите электродный потенциал кадмия, опущенного в раствор его соли с активностью ионов Cd+2=1,0 моль/л (φ0 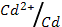 = - 0.40 В)
= - 0.40 В)
1) 0,59 В; 2) нет ответа; 3) – 0,34 В; 4) – 0,059 В; 5) – 0,80 В?
4. Вычислите электродный потенциал хрома, опущенного в раствор его соли с активностью ионов Cr3+=1*10-3 моль/л (φ0 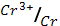 = - 0.744 В)
= - 0.744 В)
1) – 0,685 В; 2) – 0,744 В; 3) – 0,803 В; 4) – 0,059 В; 5) нет ответа?
5. Вычислите электродный потенциал водородного электрода в кислой среде при рН=2
1) – 0,059 В; 2) – 0,0295 В; 3) нет ответа; 4) 0,59 В; 5) – 0,118 В?
Вариант 2
1. Вычислите электродный потенциал водородного электрода в щелочной среде при рН=13
1) – 0,41 В; 2) – 0,77 В; 3) – 0,59 В; 4) нет ответа; 5) 0,41 В?
2. Вычислите электродный потенциал водородного электрода, погруженного в чистую воду (какова концентрация ионов водорода в воде)
1) 0,00 В; 2) 0,59 В; 3) 0,41 В; 4) – 0,059 В; 5) – 0,41 В?
3. Стандартный электродный потенциал серебра равен φ0 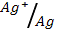 = 0.80 В. Каков будет потенциал 1 кг металлического серебра в 1 М растворе AgNO3
= 0.80 В. Каков будет потенциал 1 кг металлического серебра в 1 М растворе AgNO3
1) 0,80 В; 2) 0,177 В; 3) 0,236 В; 4) нет ответа; 5) 0,98 В?
4. Какие из перечисленных ниже металлов могут служить анодом в гальваническом элементе, катодом которого является железо
(φ0 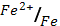 = - 0.44 В)
= - 0.44 В)
1) Cu (φ0 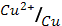 = 0.34 В); 2) Cd (φ0
= 0.34 В); 2) Cd (φ0 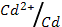 = - 0.40 В); 3) нет ответа;
= - 0.40 В); 3) нет ответа;
4) Ag (φ0 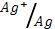 = 0.80 В); 5) Pb (φ0
= 0.80 В); 5) Pb (φ0 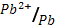 = - 0.13 В)?
= - 0.13 В)?
5. Какие из перечисленных ниже металлов могут служить катодом в гальваническом элементе, анодом которого является кобальт
(φ0 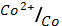 = - 0.28 В)
= - 0.28 В)
1) Al (φ0 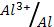 = - 1.66 В); 2) Cr (φ0
= - 1.66 В); 2) Cr (φ0 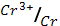 = - 0.744 В); 3) нет ответа;
= - 0.744 В); 3) нет ответа;
4) Mg (φ0  = - 2.38 В); 5) Pb (φ0
= - 2.38 В); 5) Pb (φ0 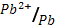 = - 0.13 В)?
= - 0.13 В)?
Вариант 3
1. Укажите, в каком гальваническом элементе железо является анодом
1) Hg/Fe/Fe2+//Hg2+/Hg; 2) нет ответа; 3) Ве/Be2+//Fe2+/Fe;
4) Mg/Mg2+//Fe2+/Fe; 5) Fe/Be/Be2+//Fe2+/Fe?
2. Гальванический элемент состоит из медной и серебряной пластинок, погруженных в молярные растворы солей этих металлов. Определите э.д.с. элемента. Какой из металлов расходуется при работе элемента?
(φ0 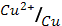 = 0.34 В; φ0
= 0.34 В; φ0 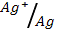 = 0.80 В)
= 0.80 В)
1) – 0,46 В, Cu; 2) 0,46 В, Cu; 3) 1,14 В, Ag; 4) 1.14 B, Cu; 5) 0.46 В, Ag?
3. Из каких полуэлементов следует составить гальванический элемент, что бы его э.д.с. была максимальной
1) Mg/Mg2+ и Cu/Cu2+; 2) Cu/Cu2+ и Ag/Ag+; 3) Fe/Fe2+ и Pb/Pb2+;
4) Со/Со2+ и Au/Au+; 5) Pb/Pb2+ и Au/Au+?
4. Определите э.д.с. гальванического элемента, состоящего из медного электрода, погруженного в 0,1 М раствор сульфата меди и нормального водородного электрода (φ0 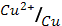 = 0.34 В).
= 0.34 В).
1) 0,31 В; 2) 0,34 в; 3) 0,37 В; 4) – 0,34 В; 5) нет ответа?
5. Вычислите э.д.с. гальванического элемента, в котором проходит реакция диспропорционирования 2Cu+=Cu2++Cu, если φ0 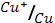 = 0.52 В;
= 0.52 В;
φ0 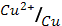 = 0.34 В; φ0
= 0.34 В; φ0 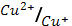 = 0.15 В.
= 0.15 В.
1) 0,86 В; 2) 0,18 В; 3) 0,49 В; 4) 0,37 В; 5) 1,01 В?
Вариант 4
1. Какая из ниже указанных схем гальванических цепей является концентрационной
1) Со/Со2+(С1=0,01 моль/л)// Со2+(С2=0,1 моль/л)/Со;
2) Со/Со2+(С1=1 моль/л)// Со2+(С2=1 моль/л)/Со;
3) Ве/Be2+// Со2+/Со; 4) нет ответа;
5) Со/Со2+(С1=1 моль/л)// 2Н+(С2=1 моль/л)/Н2, Pt?
2. Вычислите электродвижущую силу концентрационного элемента
Сu/Сu2+(С1=0,01 моль/л)// Сu2+(С2=0,1 моль/л)/Сu (φ0 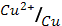 = 0.34 В)
= 0.34 В)
1) 0,34 В; 2) – 0,34 В; 3) нет ответа; 4) 0,0295 В; 5) – 0,0295 В?
3. Имеется гальванический элемент (-) Ag/Pb/Pb2+//Ag+/Ag (+). Как изменится его э.д.с., если в раствор, содержащий ионы свинца, добавить сероводород
1) увеличится; 2) уменьшится; 3) останется неизменной;
4) элемент прекратит работу?
4. Гальванический элемент составлен из двух водородных электродов, из которых один – стандартный. В какой из перечисленных растворов следует погрузить другой электрод для получения наибольшей электродвижущей силы
1) 0,1 М H2SO4; 2) 0.1 M CH3COOH; 3) 0.1 M H3PO4;
4) 0.1 M HNO3; 5) 0.1 M HCl?
5. Каким из предлагаемых способов можно увеличить э.д.с. гальванического элемента Pt, H2/HCl(C1)//HCl(C2)/H2, Pt
1) нет ответа; 2) увеличить концентрацию HCl у анода и уменьшить у катода;
3) уменьшить концентрацию НCl у анода и катода;
4) уменьшить концентрацию HCl у анода и увеличить у катода;
5) увеличить концентрацию HCl у анода и катода?
Вариант 5
1. Рассчитайте э.д.с. концентрационного элемента, состоящего из двух водородных электродов, в растворы с рН 2 и 4.
1) нет ответа; 2) 0,059 В; 3) 0,236 В; 4) 0,354 В; 5) 0,0295 В.
2. Внутри клеток млекопитающих рН=7,0, а в окружающей жидкости рН=8,0. Рассчитайте возникающую в этих условиях э.д.с.
1) 0,059 В; 2) 0,0295 В; 3) 0,118 В; 4) 0,236 В; 5) нет ответа?
3. Токообразующая реакция гальванического элемента Cu(к)+Сl2(г)=Cu2++2Cl-. Вычислите э.д.с. гальванического элемента и изменение энергии Гиббса
(φ0 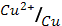 = 0.34 В; φ0
= 0.34 В; φ0 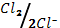 = 1.36 В).
= 1.36 В).
1) Е=1,70 В, ∆G=164,050 кДж; 2) Е=1,70 В, ∆G=328,100 кДж; 3) нет ответа; 4) Е=1,02 В, ∆G=196,860 кДж; 5) Е=1,02 В, ∆G=98,430 кДж?
4. Собрана гальваническая цепь из электродов
NO-3+2Н++2е = NO-2+Н2О φ0= 0,940 В; MnO-4+8H++5e = Mn2++4H2O
Вычислите стандартный потенциал электрода MnO-4/ Mn2+, если э.д.с цепи при следующем условии равно 0,570 В.
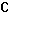 =
= 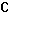 =
= 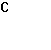 =
= 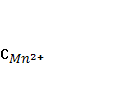 =
= 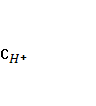 = 1 моль/л.
= 1 моль/л.
1) φ0=1,51 В; 2) φ0=0,37 В; 3) φ0=-0,63 В; 4) φ0=-1,51 В; 5) φ0=0,16 В?
5. В сернокислотный раствор, содержащий Al3+, Fe2+, Cd2+, Cu2+ (по 1 моль/л), погружены платиновые электроды. На электродах медленно увеличивается напряжение и после начала выделения одного из металлов оно поддерживается постоянным. Какой металл выделится?
1) алюминий; 2) железо; 3) кадмий; 4) медь;
5) будут выделяться все металлы?
Вариант 6
1. Раствор содержит ионы Be2+, Pb2+, Hg2+, Co2+ в одинаковой концентрации. В какой последовательности эти ионы будут выделятся при электролизе, если напряжение достаточно для выделения любого металла
1) нет ответа; 2) Be2+, Pb2+, Hg2+, Co2+; 3) Be2+, Co2+, Pb2+, Hg2+;
4) Pb2+, Co2+, Be2+, Hg2+; 5) Hg2+, Pb2+, Co2+, Be2+?
2. Какой процесс протекает на катоде при электролизе водного раствора нитрата кадмия
1) 2H2O + 2e→ H2 + 2OH-; 2)Cd+2 + 2e = Cd; 3) 2H2O – 4e → O2 + 4H+;
4) Cd – 2e → Cd2+; 5) 2NO-3 – 2e → 2NO2 + O2?
3. Электролизу водного раствора каких веществ отвечает катодный процесс 2H2O + 2e → H2 + 2OH-
1) KOH; 2) HCl; 3) Pb(NO3)2; 4) FeCl3; 5) HgCl2?
4. Какой процесс протекает на катоде при электролизе водного раствора фосфорной кислоты, если катод медный
1) Cu -2e→Cu2+; 2) 2H2O+2e→H2+2OH-; 3) 2 H2O-4e→O2+4Н+;
4) 2H++2e→H2; 5) нет ответа?
5. Электролизу подвергаются водные растворы следующих солей: KCl, Pb(NO3)2, ZnSO4, CuCl2. При электролизе какой соли на катоде будет выделяться газообразный водород
1) выделяться не будет; 2) KCl; 3) Pb(NO3)2; 4) ZnSO4; 5) CuCl2?
Date: 2015-09-24; view: 1172; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |