
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Основные количественные характеристики процессов экстракции
Несмотря на то что экстракция как метод разделения длительное время применяется в аналитической химии и химической технологии, теоретические основы этого метода долгое время оставались неизученными. В частности, долгое время оставались неизученными основные количественные характеристики экстракционных процессов, что было определенным препятствием для широкого внедрения экстракции в практику. Для расчета количества вещества, которое экстрагируется органическими растворителями, необходимо знать константу и коэффициент распределения, степень экстракции и т. д.
М. Бертло и Ю. Юнгфлейш были первыми исследователями, которые в 1872 г. на основании экспериментальных данных показали, что отношение равновесных концентраций вещества, распределяющегося между двумя жидкими фазами, является постоянным. Это отношение термодинамическим путем было выведено В. Нернстом, который в 1891 г. сформулировал закон распределения.
Согласно закону распределения, вещество, растворенное в двух несмешивающихся или ограниченно смешивающихся жидкостях, распределяется между ними в постоянном отношении. Это отношение для идеальных систем зависит только от температуры, природы вещества и не зависит от концентрации.
Из этого закона следует, что при одновременном растворении нескольких веществ каждое из них распределяется между обеими жидкими фазами таким образом, как будто в системе нет никаких других веществ, подлежащих распределению. Закон распределения справедлив лишь в том случае, если распределяемое вещество в обеих фазах находится в одной и той же форме.
Константа распределения вещества. Постоянная величина, выражающая отношение концентраций распределяемого вещества, находящегося в обеих фазах (после наступления равновесия) в одной и той же форме, называется константой распределения:

где Р о — константа распределения: [А] о —концентрация вещества в фазе органического растворителя, моль/л; [А] В — концентрация вещества в водной фазе, моль/л.
Величина константы распределения зависит от природы распределяемого вещества, состава и свойств применяемого экстрагента, температуры, при которой производится экстракция. Эта константа не зависит от равновесных концентраций экстрагируемого вещества и объемов водной и неводной фаз. Числовое значение константы распределения можно вычислить и по другой формуле (9), исходя из величины степени экстракции соответствующего вещества и объемов жидких фаз.
Коэффициент распределения. При расчетах константы распределения вещества по формуле (1) необходимо быть уверенным в том, что распределяемое вещество в обеих фазах находится в одинаковой форме (в одинаковом молекулярном состоянии). Однако во многих экстракционных системах не соблюдается указанное выше условие. В одной из жидких фаз могут происходить диссоциация, ассоциация, сольватация, гидролиз распределяемого вещества, образование комплексов и т. д. Для расчетов экстракционных равновесий в таких системах не принимают во внимание форму существования вещества в каждой фазе, а учитывают только отношение суммарных (аналитических) концентраций распределяемого вещества в обеих фазах.
На основании определения суммарных концентраций можно рассчитать не константу, а коэффициент распределения данною вещества в применяемой системе растворителей (вода — органический растворитель). Коэффициент распределения — это отношение суммарной аналитической концентрации вещества в фазе органического растворителя к суммарной аналитической концентрации этого вещества в водной фазе (без учета того, в какой форме находится вещество в каждой фазе):

где D — коэффициент распределения; С о — суммарная аналитическая концентрация вещества в фазе органического растворителя, моль/л; С В — суммарная аналитическая концентрация вещества в водной фазе, моль/л.
Степень экстракции. Степень экстракции (процент экстракции) — это отношение количества экстрагированного вещества к общему (начальному) количеству этого вещества в водном растворе:

где R — степень экстракции вещества, %; А — количество вещества, которое экстрагировалось органическим растворителем; N — общее (начальное) количество вещества в водном растворе.
Количество вещества А, которое экстрагируется органическим растворителем, можно определить экспериментальным путем, применив соответствующий метод количественного определения. Зная начальное количество вещества и количество этого вещества, перешедшего в органический растворитель, рассчитывают степень экстракции.
Степень экстракции вещества можно определить не только экспериментальным путем, но и путем соответствующих расчетов, зная константу или коэффициент распределения вещества, а также отношение объемов водной фазы и фазы органического растворителя. Степень экстракции с указанными величинами связана следующим соотношением:

где R —степень экстракции; Р о — константа распределения; V B — объем водной фазы, мл; V o — объем фазы органического растворителя, мл.
В формуле (4) отношение объема водной фазы к объему фазы органического растворителя заменяют величиной г:

Объем органического растворителя, необходимого для экстракции, рассчитывают по формуле

После соответствующего преобразования формулы (4) степень экстракции рассчитывают по уравнению

Из формулы (7) можно рассчитать величину r:

Если известна степень экстракции R и отношение объемов фаз r, то константу распределения Р 0 можно рассчитать при помощи следующего уравнения:

На основании числовых значений константы распределения и степени экстракции можно рассчитать ряд других количественных характеристик процессов экстракции.
Ниже мы приведем несколько примеров расчетов ряда количественных характеристик экстракционных процессов неэлектролитов, к числу которых относятся многие органические соединения, имеющие значение в фармации и токсикологии.
Расчет объема органического растворителя, необходимого для однократной экстракции. Примеры этих расчетов приведены ниже.
Пример 1. Вычислить объем органического растворителя, который необходимо взять для однократной экстракции 99 % вещества из 100 мл раствора, если константа распределения Р 0 этого вещества между органическим растворителем и водной фазой равна 20.
Для решения этой задачи пользуются формулой (7):
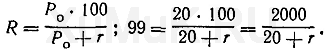
Значение r рассчитывают по формуле (8), а значение V o — по формуле (6):
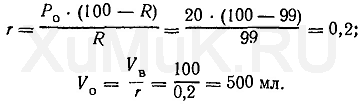
Таким образом, для однократной экстракции 99 % вещества (Р о =20) из 100 мл водного раствора требуется 500 мл органического растворителя.
Пример 2. Какой объем органического растворителя необходимо взять для однократной экстракции 99 % вещества из 100 мл водного раствора, если Ρ = 10?
Эту задачу решают аналогично предыдущей:
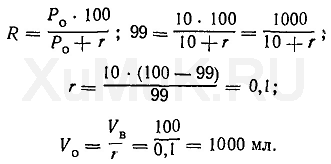
Расчеты показывают, что для однократной экстракции 99 % вещества (Р о = 10) из 100 мл водного раствора требуется 1000 мл органического растворителя.
На основании произведенных выше расчетов (см. примеры 1 и 2) можно сделать такие выводы: чем больше константа распределения Р о вещества, тем меньший объем органического растворителя требуется для однократной экстракции его из водных растворов; степень экстракции R вещества тем больше, чем меньше величина r, т. е. чем больший объем органического растворителя применяется для однократной экстракции.
Расчет объема органического растворителя для многократной экстракции. Из приведенных выше расчетов (см. примеры 1 и 2) следует, что для однократной экстракции вещества из водных растворов необходимо брать органические растворители, объемы которых значительно больше объемов водных растворов.
Учитывая это, для извлечения веществ из водных растворов производят многократную экстракцию их малыми объемами органических растворителей вместо однократной экстракции большим объемом того же растворителя. Преимущество многократной экстракции веществ малыми объемами растворителей перед однократной экстракцией большими объемами этих растворителей показано на приведенных ниже примерах.
Пример 3. Какой общий объем органического растворителя необходимо использовать для многократной экстракции, чтобы из 100 мл водного раствора извлечь 99 % вещества, если Р о = 20, а на каждую экстракцию берут по 25 мл органического растворителя?
Для решения этой задачи пользуются формулой (7).
Вначале определяют степень экстракции вещества, %:
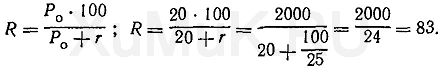
Расчеты показывают, что степень экстракции вещества при указанных выше условиях составляет 83 %. Следовательно, и при каждой последующей экстракции тоже будет экстрагироваться 83 % от оставшегося в водном растворе вещества.
При второй экстракции из водного раствора будет извлекаться Χ 2 вещества:
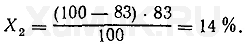
При третьей экстракции из водного раствора будет извлекаться Х 3 вещества:
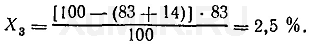
Эти расчеты показывают, что при трех последовательных экстракциях из водного раствора извлекается около 99,5 % вещества и при этом расходуется только 75 мл органического растворителя, в то время как для однократной экстракции 99 % того же вещества (см. пример 1) необходимо затратить 500 мл органического растворителя.
Приведенные выше расчеты показывают, что для извлечения вещества из водных растворов необходимо производить многократную экстракцию небольшими объемами органических растворителей вместо однократной экстракции большим объемом этих растворителей.
Количество экстракций, необходимых для извлечения заданного количества вещества из раствора. Для расчета полноты экстракции вещества определяют, сколько раз необходимо экстрагировать его из водного раствора, чтобы добиться извлечения заданного количества этого вещества.
С этой целью пользуются следующей формулой:
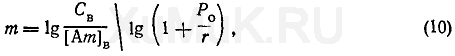
где т — количество экстракций, необходимых для извлечения заданного количества вещества; С В — начальная концентрация вещества в водном растворе, моль/л; [Ат] В — концентрация оставшегося в водной фазе вещества после т экстракций, моль/л.
Пример 4. Рассчитать число экстракций, необходимых для извлечения 99 % вещества органическим растворителем (порциями по 10 мл) из 100 мл 1 Μ водного раствора, если Р о =20.
Для решения этой задачи вначале необходимо определить [Am] в и r:
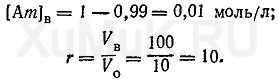
Подставим значения соответствующих величин в формулу (10).
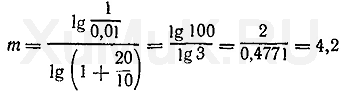
экстракции (округленно 4 экстракции).
Приведенный пример показывает зависимость числа экстракций от объемов органического растворителя и водной фазы, степени экстракции и константы распределения вещества.
Механизм процесса экстракции. Согласно теории растворов, растворение вещества в воде или в органических растворителях сопровождается образованием малопрочных соединений молекул этого вещества с молекулами растворителя. Если растворителем является вода, то в растворе образуются гидраты, а если растворителем является органический растворитель, то в растворах образуются сольваты молекул растворенного вещества. Гидраты и сольваты молекул являются малопрочными.
При взбалтывании водного раствора вещества с органическим растворителем, который не смешивается с водой, гидратная оболочка молекул растворенного вещества разрушается. Молекулы воды в гидратной оболочке замещаются молекулами органического растворителя, в результате чего образуются сольваты молекул растворенного вещества, которые легко переходят в органический растворитель.
Хорошо экстрагируются молекулы тех веществ, сольваты которых в фазе органического растворителя являются более прочными, чем гидраты этих молекул в воде.
Более сложными являются процессы экстракции электролитов, которые в водных растворах частично или полностью распадаются на ионы. Ионы, несущие определенный заряд, хорошо гидратируются диполями воды. Связь ионов с диполями воды относительно прочная. Поэтому ионы, имеющие прочные гидрат-ные оболочки, остаются в водной фазе и не экстрагируются органическими растворителями. Ими могут экстрагироваться только недиссоциированные молекулы соответствующего вещества. Это необходимо учитывать при экстракции органических веществ, являющихся слабыми электролитами. Степень экстракции этих веществ зависит от рН среды. С изменением рН раствора изменяется степень диссоциации молекул, а следовательно, изменяется и относительное количество недиссоциированных молекул вещества. С увеличением количества недиссоциированных молекул увеличивается степень экстракции слабых электролитов и наоборот.
Экстракция органических кислот. Недиссоциированные молекулы органических кислот в водных растворах являются электронейтральными и слабо гидратируются молекулами воды. При контакте водных растворов с органическими растворителями электронейтральные молекулы кислоты легко сольватируются, и поэтому переходят в слой органического растворителя.
Ионы, образующиеся в водных растворах при диссоциации слабых кислот, имеют соответствующие заряды, и поэтому легко гидратируются диполями воды. Связь молекул воды с ионами кислоты относительно прочная. Поэтому такие ионы слабо сольватируются молекулами органических растворителей и не экстрагируются органическими растворителями из водных растворов.
Изменение концентрации водородных ионов в водной фазе приводит к относительному увеличению или уменьшению количества недиссоциированных молекул, а следовательно, и к изменению экстрагируемости кислоты.
С повышением рН (т. е. с уменьшением концентрации водородных ионов в водном растворе) увеличивается диссоциация кислоты в растворе, что приводит к уменьшению ее недиссоциированных молекул. В результате этого понижается экстрагируе-мость слабой кислоты органическими растворителями из таких растворов.
При повышении концентрации водородных ионов (т. е. с понижением рН) в водном растворе увеличивается число молекул недиссоциированной кислоты, а следовательно, возрастает ее экстрагируемость органическими растворителями. При значительном повышении концентрации водородных ионов в водном растворе слабую кислоту практически полностью можно перевести в недиссоциированное состояние и этим повысить ее экстрагируемость.
Экстракция оснований. Многие органические основания, к числу которых относятся алкалоиды и их многочисленные синтетические аналоги, являются фармацевтическими препаратами. Эти основания в нейтральной среде находятся в недиссоциированном состоянии. При действии кислот на органические основания образуются их соли, которые в водных растворах диссоциируют на ионы.
Недиссоциированные молекулы органических оснований слабо гидратируются молекулами воды, но хорошо сольватируются молекулами органических растворителей. Поэтому недиссоциированные молекулы органических оснований хорошо экстрагируются из водных растворов органическими растворителями.
Ионы, образующиеся при диссоциации солей органических оснований, хорошо гидратируются молекулами воды и слабо сольватируются молекулами органических растворителей. Поэтому соли органических оснований (за небольшим исключением) не экстрагируются органическими растворителями.
Органические основания являются слабыми электролитами. Степень диссоциации их зависит от рН среды. От прибавления кислот к органическим основаниям они переходят в соли. При этом увеличивается количество ионов и уменьшается количество недиссоциированных молекул, а следовательно, уменьшается степень экстракции этих веществ органическими растворителями. От прибавления щелочей к солям органических оснований уменьшается количество ионов и увеличивается количество недиссоциированных молекул этих оснований. В результате этого в щелочной среде увеличивается степень экстракции органических оснований.
Экстракция амфотерных соединений. К числу амфотерных соединений, имеющих токсикологическое значение, относятся вещества, в молекулах которых содержится аминный азот и фенольные группы (морфин, сальсолин и др.), а также соединения, содержащие аминный азот и карбоксильную группу (аминокислоты и др.). Эти соединения в зависимости от рН среды диссоциируют как основания (в кислой среде) и как кислоты (в щелочной среде). Экстракция амфотерных соединений зависит от рН среды, так как при изменении рН изменяется количество ионов и недиссоциированных молекул амфотерных соединений. Амфотерные соединения, находящиеся в молекулярном состоянии, экстрагируются органическими растворителями. Ионы амфотерных соединений хорошо гидратируются молекулами воды и почти не экстрагируются органическими растворителями.
Наибольшие количества амфотерных соединений экстрагируются при рН, соответствующем изоэлектрической точке этих веществ. Это объясняется тем, что в изоэлектрической точке молекулы амфотерных соединений не имеют электрического заряда.
Date: 2015-09-24; view: 541; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |