
Полезное:
Как сделать разговор полезным и приятным
Как сделать объемную звезду своими руками
Как сделать то, что делать не хочется?
Как сделать погремушку
Как сделать так чтобы женщины сами знакомились с вами
Как сделать идею коммерческой
Как сделать хорошую растяжку ног?
Как сделать наш разум здоровым?
Как сделать, чтобы люди обманывали меньше
Вопрос 4. Как сделать так, чтобы вас уважали и ценили?
Как сделать лучше себе и другим людям
Как сделать свидание интересным?

Категории:
АрхитектураАстрономияБиологияГеографияГеологияИнформатикаИскусствоИсторияКулинарияКультураМаркетингМатематикаМедицинаМенеджментОхрана трудаПравоПроизводствоПсихологияРелигияСоциологияСпортТехникаФизикаФилософияХимияЭкологияЭкономикаЭлектроника

Стр. 52
Равномерное распределение молекул газа по всему объему будет более вероятным состоянием газа, чем вариант, когда смесь газа сама собой разделится на два отдельных компонента в одной и другой частях сосуда. Такое макросостояние (раздельные компоненты газа) реализуется меньшим числом способов, чем равномерное распределение, и представляется практически невероятным. Таким образом, смешение - процесс необратимый.
Введение Л. Больцманом (1872) понятия термодинамической вероятности W как числа микросостояний, посредством которых реализуется данное макросостояние, позволило интерпретировать энтропию (S) с точки зрения вероятностного состояния системы:
S = k  lnW,
lnW,
где k - постоянная Больцмана.
Таким образом, S - функция состояния системы, определяемая термодинамической вероятностью, в изолированной системе может изменяться только в сторону возрастания (если система неравновесна) или оставаться постоянной (если система находится в равновесном состоянии), т. е. 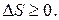
Если система находится в неравновесном состоянии, т. е. температура, давление, концентрация и т. д. в разных ее частях различны (W1 S1), то с течением времени наиболее вероятным станет такое ее состояние, когда эти параметры выравняются (W2, S2), причем W2 > W1 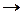 S2 > S1. Значит,
S2 > S1. Значит, 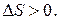
Отметим, что когда в системе наступает термодинамическое равновесие и энтропия достигает своего максимального значения S = S max, то 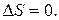
Используя статистическое рассмотрение энтропии, часто вводят понятие «порядок» или «беспорядок», т. е. энтропия - мера беспорядка. Так, если взять кусок льда и поместить его в большой стеклянный куб (система замкнута) при комнатной температуре, то с течением времени будет наблюдаться изменение состояния льда (молекул воды во льде). В начальном состоянии молекулы воды, находясь в узлах кристаллической решетки льда, будут иметь состояние, определяемое термодинамической вероятностью W1, а значит, и S1). По мере нагревания лед постепенно переходит в жидкое состояние с W2 > W1 (S2 > S1), т. е. беспорядок молекул воды стал больше, чем у молекул льда. Дальнейший нагрев воды до комнатной температуры (опыт проводили в термостате) приводит к ее испарению, превращению в пар с W3, S3, которые имеют большее значение, чем для воды (W2, S2). Таким образом, с ростом энтропии в изолированной системе беспорядок увеличивается.
Date: 2015-09-24; view: 379; Нарушение авторских прав; Помощь в написании работы --> СЮДА... |